
22.(4分)2005年诺贝尔化学奖授予三位在研究“烯烃交叉复分解反应”方面做出重要贡献的科学家。“烯烃交叉复分解反应”可简单地表示为 B1-13CH = 13CH-R1+R2-CH = CH-R2→2R1-13CH = CH-R2 现用珍烯和分子式为C4H8的链烃发生“烯烃复分解反应”合成下列烃,请写出C4H8的结构简式
(1)合成2-戊烯(CH3CH = CHCH2CH3): ;
(2)合成2-甲基-2-丁烯[CH3CH=C(CH3)2]: 。
21.(8分)Fe(OH)2在空气中极易被氧化,而使实验室制取存在一定困难,人们尝试用多种方法来制得白色的Fe(OH)2沉淀。
(1)方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①配制FeSO4溶液时,在蒸馏水中加入硫酸亚铁晶体外还需加入 。
②除去蒸馏水中溶解的O2常采用 的方法。
(2)方法二:用电解法制Fe(OH)2,实验装置如下图所示。

①电解时,电解质溶液应选用下列试剂中的 (填编号字母)
A.氯化钠溶液 B.稀硫酸
C.硫酸铜溶液 D.碳酸钠溶液
②电解时阴极的电极反应为: 。
③电解质溶液面复盖一层苯所起的作用是 。
(3)方法三:在如下图装置,先打开止水夹,反应一段时间后关闭止水夹,右侧试管内可见到白色沉淀。
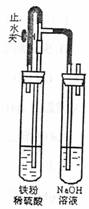
①该法可使沉淀的白色维持较长时间,其原因是 。
②若该装置不漏气而操作不当,在右侧试管中得不到沉淀,其原因是 。
20.(8分)在足量的氯化亚铁稀溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因有两种猜测:
(1)猜测1:溶液呈黄色不是发生化学反应所致,黄色是溶液中含有 引起的(填微粒的化学式)。要证明该溶液中确有该物质,可在溶液中加入 ,观察到 现象。
(2)猜测2:溶液呈黄色是发生化学反应所致,则黄色是溶液中 引起的,反应的离子方程式为 。要证明该溶液中确有该物质,可在溶液中加入 ,观察到 现象。
19.(6分)
已知A、B、C是常见的单质,在一定条件下相互转化的关系如下图所示(有部分物质省略)。
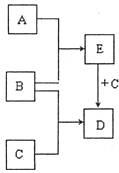
(1)若常温下,B为气体,A为红色固体,C元素在自然界中含量位于第三,E为黑色固体,写出C+E→D的化学方程式 。
(2)若常温下A、B均为气体,C为金属单质,D为黑色晶体,写出C+E→D的化学方程式 。
(3)若常温下B为气体,A为黑色非金属固体, C为金属,写出C+E→D的化学方程式 。
18.(8分)回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO2-4和Cl-,测得三种离子的浓度分别是0.01mol·L-1、0.0035mol·L-1和0.004mol·L-1,该溶液的pH为 。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一反应 。
(3)液氨类似于水的电离,试写出液氨的电离方程式 ;在液氨中加入NH4Cl,则平衡将向 移动。
(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来的体积的m倍和n倍,稀释后两溶液的pH仍相同。则m n(选填“>”、“<”或“=”);若改用pH相同的盐酸和硫酸溶液,进行上述操作,则m n(选填“>”、“<”或“=”)。
17.(7分)X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈液性;W元素最高正价是+7价。回答下列问题:
(1)元素X氢化物的电子式为 。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是 。
(3)元素Z能与氢元素形成一价阴离子,该阴离子的电子总数是 。
(4)元素W与元素X相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应。
(5)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 (用酸的分子式表示),理由是 。
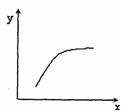
16.在一密闭容器中通入A、B两种气体,在一定条件下反应 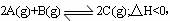
当反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是 ( )
|
|
x |
y |
|
A |
再通入A |
B的转化率 |
|
B |
压强 |
A的百分含量 |
|
C |
温度 |
混合气体的平均相对分子质量 |
|
D |
加入催化剂 |
A的质量分数 |
15.室温下,HA、H2B两种酸溶液的浓度都是0.1mol·L-1,pH依次为1.5和2.0,则下列结论正确的是 ( )
A.H2B的酸性比HA的强
B.当NaA、NaHB、Na2B的溶液浓度都是0.1mol·L-1时,Na2B溶液的pH最大
C.HA和H2B不一定是弱酸
D.溶液中B2-、HB-、A-均能和强酸反应,也能和强碱反应
14.Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ==== 2Na2FeO4 + 2Na2O+2Na2SO4+O2↑,对此反应下列说法不正确的是 ( )
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2molFeSO4发生反应时,共有10mol电子转移
13.常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HCl溶液的体积比为 ( )
A.9:2 B.2:9 C.1:9 D.10:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com