
7.常温下,由水电离出的氢离子浓度为1×10-13mol/L的溶液中,一定不能大量共存的离子组是 ( )
A.Cl-、AlO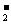 、Na+、K+ B.Fe3+、NO
、Na+、K+ B.Fe3+、NO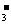 、MnO
、MnO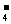 、K+
、K+
C.Fe2+、NO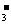 、Ba2+、Cl- D.SO
、Ba2+、Cl- D.SO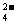 、Na+、Cl-、K+
、Na+、Cl-、K+
6.设阿伏加德罗常数的值为NA,则下列说法中正确的是 ( )
A.22.4 L HCl 中含有的分子数为NA
B.标准状况下,当氧气与氦气的原子数均为NA时,它们具有相同的体积
C.常温常压下,由6g NO2和40 g N2O4组成的混合气体中原子总数为3NA
D.1mol Na2O2中所含的阴离子数为2NA
5.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是( )
A.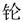 第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周期
第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周期
4.据报道,在我国各地发生过多次因混合洁污剂而引起氯气中毒事件,据此推测,相混合的洁污剂中最有可能含有 ( )
A.ClO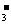 、Cl-、OH- B.ClO-、Cl-、H+
、Cl-、OH- B.ClO-、Cl-、H+
C.NaClO、NaClO3 D.NaClO、NaCl
3.据悉,多哈亚运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生化学反应:5KClO3十6P=3P2O5+5KCl。下列有关该反应的叙述中,正确的是 ( )
A.反应中红磷是氧化剂
B.发令时产生的白烟全是KCI固体
C.反应中消耗3molP时,转移电子的物质的量为15mol
D.“火药”中的红磷可以用白磷代替
2.下列各种微粒的表示方法中,不正确的是 ( )
A.甲基的电子式: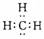 B.次氯酸分子的结构式:H-O-Cl
B.次氯酸分子的结构式:H-O-Cl
C.硫离子的结构示意图: D.碳-12的原子符号:
D.碳-12的原子符号: 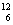 C
C
1.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不吻合的是 ( )
A.用“绿色化学”工艺,使原料完全转化为产物
B.推广燃煤脱硫技术,防治SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药、化肥提高粮食产量
25.(6分)实验室有甲、乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲、乙两瓶溶液的成分及其物质的量浓度,现操作如下:
①量取25.00mL甲溶液,向其中缓慢滴加乙溶液15.00mL,共收集到二氧化碳气体224mL。
②量取15.00mL乙溶液,向其中缓慢滴加甲溶液25.00mL,共收集到二氧化碳气体112mL。
(1)写出上述过程①中所涉及反应的离子方程式 ;
②所涉及反应的离子方程式 。
(2)甲是 ,甲溶液的物质的量浓度为 mol·L-1,乙溶液的物质的量浓度为 mol·L-1。(二氧化碳在溶液中的少量溶解忽略不计)
24.(5分)
(1)在工业合成氨的生产原料气中V(N2):V(H2)=1:3,若将标准状况下1512m2的原料气通入合成塔中,达到平衡时,平衡混和气体中氨的体积分数为20%,则生成氨气的质量为 kg。
(2)硝酸工业的尾气中主要含有NO、NO2气体,工业上可用氨气进行治理,使其转化为无毒的氮气。有关反应的化学方程式为:
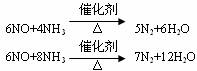
现有NO和NO2的混合气体15L,用氨气进行处理,恰好消耗同温同压下的NH317L。则原混合气体中NO与NO2的物质的量比之为 。
23.(8分)对氨基苯磺酸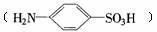 是一种重要的化工原料,它具有两性,既能和氢氧化钠溶液反应,也可和盐酸反应。工业上常用苯为原料来合成对氨基苯磺酸。请回答下列问题:
是一种重要的化工原料,它具有两性,既能和氢氧化钠溶液反应,也可和盐酸反应。工业上常用苯为原料来合成对氨基苯磺酸。请回答下列问题:
(1)请写出对氨基苯磺酸和氢氧化钠溶液反应的化学方程式 。
(2)请写出对氨基苯磺酸和盐酸反应的化学方程式 。
(3)已知下列(I)~(IV)四个有机反应:
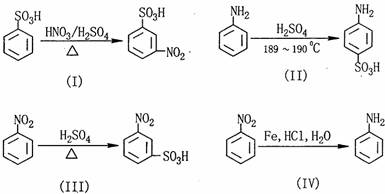
根据上述信息,试完成以下合成路线:
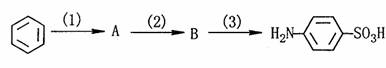
写出上述合成路线中,A、B的结构简式:A: B: 。
步骤(1)的反应条件是 ;上述(IV)反应是氧化反应还是还原反应? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com