
6.实验室用锌和稀硫酸反应制氢气,下列操作能使产生氢气的反应速率明显加快的是( )
①增加锌的用量 ②改用浓硫酸 ③加入少量石墨颗粒 ④适当加热
A.②③ B.①③ C.②④ D.③④
5.下列说法中不正确的是 ( )
①钠、铜丝都能在氯气中燃料产生白烟
②氢气在氯气中燃料,火焰为淡蓝色
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发了,剩下的就是水
A.只有① B.①和② C.①和④ D.①②③④
4.纳米材料是指颗粒的三维线度中的任一维在1nm~100nm范围内的材料。纳米技术所带动的技术革命对人类产生了很大的影响。下列关于纳米技术的叙述中不正确的是( )
A.将“纳米材料”分散到液体分散剂中可制得胶体
B.用纳米金属颗粒粉剂作催化剂可加快反应速率,提高反应物的平衡转化率
C.用纳米颗粒粉剂做成火箭的固体燃料将有更大的推动力
D.金属银能抑菌、杀菌、纳米银粒子植入内衣织物中,有奇特的抑菌、杀菌效果
3.小李在学习酸碱指示剂与常见酸、碱溶液的作用时,归纳了如图所示的关系。图中a、b、c、d是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示的颜色,则下列表示不正确的是( )
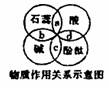
A.a--紫色 B.b--蓝色 C.c--红色 D.d--无色
2.为了实现“绿色奥运”,使首都天空更蓝,空气更清新,目前我国禁止没有申领到“绿色”通行证的高污染车进京。高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有 ( )
A.二氧化碳 B.氮氧化合物 C.硫化氢 D.氮气
1.洲际导弹飞行时,弹头与空气剧烈摩擦能产生5000-10000℃的高温,导弹很有可能没有击中目标就会被烧毁在大气层中。科学家将石英纤维制成布,并用塑料层层粘结,做成玻璃钢“头盔”罩在弹头上。当摩擦产生高温时,“头盔”被烧光了,导弹却已着陆击中目标。这种“头盔”材料叫“烧失材料”,它做的“头盔”能保护导弹不被烧毁的主要原因是( )
A.塑料被烧光使导弹温度急剧降低
B.制导弹的材料本身耐高温
C.SiO2熔点高,沸点更高,当它熔化并汽化时吸收大量的热,从而降低了导弹的温度
D.SiO2硬度大,导热能力强,能将热能转化为其他形式的能
29.(15分)据报道,80万吨乙烯工程于2007年12月8日在武汉正式形式建设。乙烯被称为“石化工业之母”,乙烯发展水平是一个国家石油化学工业水平的重要标志之一。下图是乙烯的有关转化关系:
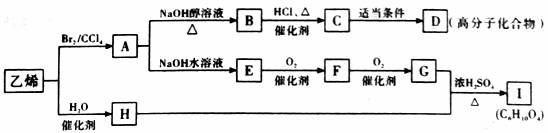
请回答下列问题:
⑴简述乙烯的一种重要工业用途:
⑵实验室制取乙烯的化学方程式为:
⑶D的结构简式为:
⑷I(C6H10O4)有多种同分异构体,其中符合HOOC-COOC4H9的同分异构体共有_______ 种
⑸写出下列转化的化学方程式并指出指定反应的反应类型
E→F:
G+H→I: ,反应类型:
28.(18分)已知乙二醇晶体的熔点为101.1℃,易升华(起始升华温度为100℃),受热分解的温度为157℃,己二酸与澄清石灰水反应的化学方程式为
H2C2O4+Ca(OH)2→CaC2O4↓(白色)+2H2O
为探究己二酸晶体(H2C2O4·2H2O)受热分解的产物,设计如下实验(装置夹持仪器已省略):
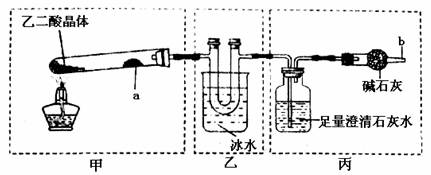
回答下列问题:
⑴己二酸晶体(H2C2O4·2H2O)受热完全分解的化学方程式为:
⑵a处试剂的名称是 ,反应一段时间后a处的现象为
⑶足量澄清石灰水的作用是
装置乙不能缺少,理由是
⑷丙中b与逸出的气体可能是 。检验的方法是
⑸简述检查上述装置气密性的方法:
⑹己二酸可能具有的性质是 (填序号)
A.能与银氨溶液发生银镜反应 B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2 D.能使蓝墨水褪色
27.(12分)下图中A-H均由短周期元素组成(部分产物已略去),H是生活中的常用物质,也是化工生产的重要原料。
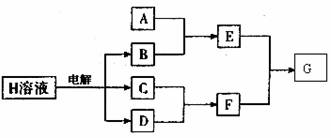
请回答:
⑴H的化学式为:
⑵若A是一种常见酸性化氧物,且可用于制玻璃。写出A和碳反应制半导体材料的化学方程式:
⑶若A是第三周期某金属元素的单质,当F的水溶液过量时,G为可溶性盐;当F的水溶液不足时,C为沉淀。写出E与少量F的水溶液反应的离子方程式:
⑷若A是一种常用化肥的主要成分,E与F反应有白烟产生。E分子的结构呈___________ 形。若在标准状况下,用体积为V L的烧瓶收集满F后做喷泉实验,假设溶液充满烧瓶且溶质不扩散,则该溶液中溶质的物质的量浓度为 (保留三倍小数)。
26.(15分)几种短周期元素的原子半径及部分化合价如下表:
|
元素代号 |
A |
B |
C |
D |
E |
F |
G |
|
部分化合价 |
+1 |
-2 |
+5、-1 |
+4、-2 |
+4、-4 |
+3 |
+1 |
|
原子半径/nm |
0..37 |
0.074 |
0.099 |
0.102 |
0.117 |
0.143 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答下列有关问题:
(1)D元素在周期表中位于第 周期,第 族。
(2)B与E所形成化合物的晶体类型是
D与G所形成化合物的电子式为
(3)B、D、G形成的一种化合物X在水溶液中显碱性,则X的化学式为 ;将X投入稀盐酸中的现象是
(4)B的气态氢化物比D的气态氢化物沸点高,主要原因是
(5)A、B、G形成的一种化合物Y与C的单质在一定条件下反应时,生成的氧化产物与还原产物的物质的理之比为1:5,则反应的离子方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com