
9.下列化学用语表达不正确的是 ( )
A.丙烷的球棍模型:
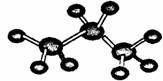
B.向Ba(OH)2溶液中加入过量的NaHSO4溶液的离子方程式:
Ba2++2OH-+2H++SO2-4 = BaSO4↓+2H2O
C.NaHCO3的电离方程式:NaHCO3 = Na++H++CO2-3
D.S2-的结构示意图: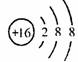
|
A.汽油燃烧时将全部的化学能转化为热能
B.若存在简单阴离子R2-,则R一定属于VIA族
C.向饱和AgCl溶液中加入盐酸,Ksp变大
D.物质的分类:HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
21.(12分)
 I.某温度下,在一个容积可变的密闭容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol和4mol,此时容器容积为4L。则此温度下该反应的平衡常数K=
。保持温度和压强不变,将各组分的物质的量都减少1mol,此时,容器的容积为
,该反应的浓度商Q= 。此时,平衡 移动(填“向左”、“向右”或“不”)
I.某温度下,在一个容积可变的密闭容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol和4mol,此时容器容积为4L。则此温度下该反应的平衡常数K=
。保持温度和压强不变,将各组分的物质的量都减少1mol,此时,容器的容积为
,该反应的浓度商Q= 。此时,平衡 移动(填“向左”、“向右”或“不”)
II.2007年度中国国家科学技术最高奖授予了石油化工催化专家闵恩泽,以表彰他在催化剂研究方面作出的突出贡献。氯化汞(HgCl2)和氯化铝(AlCl3)都有有机化工生产中常用的催化剂。
(1)氯化汞是一种能溶于水的白色固体,熔点276℃,是一种弱电解质,在水溶液中分步电离,写出其第一步电离的方程式 。
氯化汞可以被氯化亚铁在溶液中还原为氯化亚汞(HgCl2,白色沉淀),写出该反应的离子方程式 。若该反应是一个可逆反应,写出在常温下该反应的平衡常数表达式 。
(2)无水氯化铝用作石油裂解及催化重整的催化剂。能否直接加热蒸干氯化铝水溶液获得无水氯化铝?为什么?(用简要的文字叙述和必要的化学方程式说明)
[选做部分]
共2个题,考生从中选择1个作答。
选做[物质结构与性质](10分)下面的表格是元素周期表的一部分,其中的序号对应的是元素。
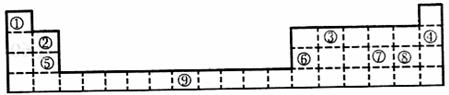
请回答下列问题:
(1)按原子轨道的重叠方式看,元素①③形成的相对分子的质量最小的分子中,含 键;元素⑤和⑧形成的化合物晶体类型为 。
(2)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的气态化合物分子的空间构型为 。
(3)表中某元素最外电子层上p电子数比s电子数少1,则该元素的元素符号为 。
(4)②④⑤⑥四种元素的第一电离能由大到小的顺序是(填序号) 。
(5)元素⑨的价电子排布式为 。
选做[有机化学基础](10分)有机物A由碳、氢、氧三种元素组成,通过一定条件可以发生以下转化,C是一种有机溶剂,F是一种塑料,H是一种抗冻剂,H与D具有相同的碳原子数,且与D同类别,1molH燃烧后生成2mol二氧化碳。
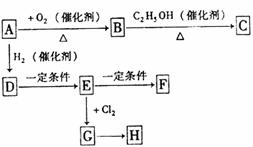
试回答:
(1)A的结构简式是 ,E→F的反应类型 。
(2)写出下列反应的化学方程式
①B→C
②G→H
(3)C有多种同分异构体,写出一种既能水解又能发生银镜反应的C的同分异构体的结构简式 ,
其名称是 。
20.(8分)已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性。各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
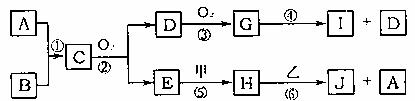
(1)写出反应②的化学方程式 。
(2)反应④中每消耗1molG,转移电子的物质的量为 。
(3)反应⑥的离子方程式是 。
(4)实验室中保存I的方法是 。
19.(10分)A、B、C、D、E、F均为短周期元素,且原子序数依将增大。A、E同主族,B、C是同周期相邻的两种元素。A、C的质子数之和等于D的质子数,A+离子与D2-离子的核外电子数之和等于E+离子的核外电子数,C原子与E+离子的核外电子数之和等于F原子的核外电子数。试回答下列问题:
(1)C元素的原子结构示意图 。
(2)A、D、E、F的四种离子半径由大到小的顺序是(用离子符号表示) 。
(3)A和C的单质可化合生成甲。已知生成1mol甲时,放出热量46.11kJ。写出该反应的热化学方程式 。
(4)A、B、D可组成分子式为B2A6D的有机物乙,1mol乙能与足量金属钠反应放出标准状况下11.2L气体。写出乙蒸气跟氧气混合通过灼热的铜时发生反应的化学方程式 。
(5)A和D可组成原子个数比为1:1的化合物丙,将F的单质通入丙的水溶液中,生成一种强酸,且有气体放出。该反应的化学方程式是 。
(6)E和F可组成化合物丁。用惰性电极电解丁的水溶液一段时间后,假设生成的气体全部从体系中逸出,要使是解后的溶液完全复原,须向溶液中加入 (填化学式)。
18.(4分)铁的氧化物有多种作途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式 。某赤铁矿除了含Fe2O3之处,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是 。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?
。
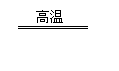 (3)合成氨工业中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为1:2时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:
(3)合成氨工业中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为1:2时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:
2 Fe2O3 + C 4FeO+CO2↑。
实验教师提供了12g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为 g。
该小组设计了多个实验方案来测定所得产品是否符合要求。其中一个实验方案是用氢气还原加热的混合物,测定铁的质量分数。在用锌跟稀硫酸反应制取氢气时,该小组的同学向稀硫酸中加入少量硫酸铜溶液,目的是 。
当混合物中铁的质量分数为 (用化简的分数表示)时,该产品合格。
17.(6分)某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
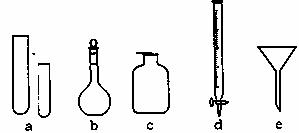
(1)指导教师要求同学们写出仪器的名称,甲同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则该空不需要填写。)
|
仪器编号 |
a |
b |
c |
d |
e |
|
名称 |
试管 |
溶量瓶 |
集气瓶 |
碱式滴定管 |
普通漏斗 |
|
改正的名称 |
|
|
|
|
|
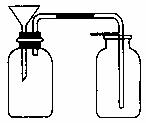
(2)关于e的用途,乙同学说:组成防倒装置。你还能说出其他两种用途吗?
① ;
② 。
(3)丙同学想用右图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上面的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。
16.已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
CH3OH(g)=CH3OH(l) △H2=-Q2kJ·mol-1
2CH3OH(g)+3O2 = 2CO2(g)+4H2O(g) △H3=-Q3kJ·mol-1(Q1,Q2,Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)
A.Q1+Q2+Q3 B.0.5Q3-Q2+2Q1
C.0.5Q3+Q2-2Q1 D.0.5(Q1+Q2+Q3)
第Ⅱ卷(选择题,共40分)
|
[必做部分]
15.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:
 2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B.其它条件不变,将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.其它条件不变,若增大压强,则物质Y的转化率减小
D.其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0
14.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是 ( )
 A.H2Y的电离方程式:H2Y 2H++Y2-
A.H2Y的电离方程式:H2Y 2H++Y2-
B.该酸式盐溶液中离子浓度关系:c(H+)+c(Na+)=c(OH-)+c(Y2-)+c(HY-)
C.该酸式盐溶液中离子浓度关系:c(H+)+ c(H2Y) =c(OH-)+c(Y2-)
D.该酸式盐溶液中离子浓度大小关系: c(Na+)> c(OH-)> c(H+)>c(HY-)
13.一些科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学化合氨的有关叙述正确的是 ( )
A.N2在阴极上被氧化
B.可选用铁作为阳极材料
C.承极的电极反应式是N2+6e-+6H+→2NH3
D.该过程的总反应式是N2+3H2 2NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com