
32.(8分)[化学-物质结构与性质]
A、B、C、D、E五种元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol-1):
|
|
I1 |
I2 |
I3 |
I4 |
|
C |
738 |
1451 |
7733 |
10540 |
|
D |
577 |
1817 |
2745 |
11578 |
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显 价,D显 价。
(2)某单质甲与化合物AB分子中电子总数相等,则甲分子中包含1个 键,2个 键。
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是 。
|
|
单键 |
双键 |
叁键 |
|
|
AB |
键能/kJ·mol-1 |
357.7 |
798.9 |
1071.9 |
|
甲 |
键能/kJ·mol-1 |
154.8 |
418.4 |
941.7 |
(4)E能与AB形成配合物,其中E提供 ,AB提供 。
31.(8分)[化学-化学与技术](本模块不命题)
30.(15分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
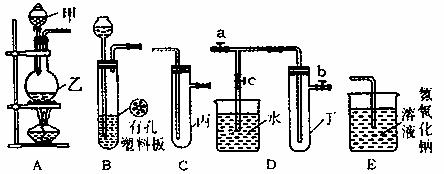
请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分成两分,进行实验I、II两个实验,实验操作、现象、结论如下:
|
实验序号 |
实验操作 |
现象 |
结论 |
|
I |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
|
II |
氯水中加入NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
请你评价实验I、II的结论是否合理?若不合理,请说明理由: 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
[选做部分]
共8个题,考生从中选择2个物理、1个化学题和1个生物题作答。
29.(13分)已知由短周期元素组成的A、B、C、D四种常见化合物分子中所含原子数目依次为2、3、4、5,其中A、B含有18个电子,C、D含有10个电子。请回答:
(1)D中含有的化学键类型有 ,已知8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式 。
(2)室温下,若向一定量C的稀溶液中逐滴加入物质的量浓度相同的A,直至A过量,生成化合物XY4Z(X、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
|
|
离子浓度由大到小的顺序 |
溶质的化学式 |
溶液的pH |
|
I |
c(XY+4)>c(Z-)>c(OH-)>c(H+) |
|
pH>7 |
|
II |
c(XY+4)=c(Z-) |
XY4Z、XY3·H2O |
|
|
III |
|
XY4Z |
pH<7 |
|
IV |
c(Z-) >c(H+)>c(XY+4)>
>c(OH-) |
|
pH<7 |
(3)B在空气中完全燃烧生成E,在一定条件下发生E与O2反应生成F。
①将0.05molE和0.03molO2放入容积为1L的密闭容器中,达到平衡,测得c(F)=0.04mol·L-1。计算该条件下反应的平衡常数K和E的平衡转化率。
②已知上述反应是放热反应,当该反应处于平衡状态时,下列措施中有利于提高E平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气
28.(14分)A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
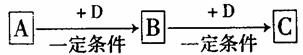
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为 (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示) ;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电沁正极的电极反应式 。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
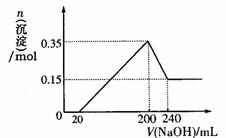
化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则固体混合物中Mg的质量为 ;NaOH溶液的物质的量浓度为 。
15.工业上由二氧化锰制备KMnO4可分两步进行:①二氧化锰与氢氧化钾共熔后通入O2:
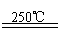 2MnO2+4KOH+O2
2K2MnO4+2H2O;②电解锰酸钾溶液:
2MnO2+4KOH+O2
2K2MnO4+2H2O;②电解锰酸钾溶液:
 2K2MnO4+2H2O
2KMnO4+H2↑+2KOH。
2K2MnO4+2H2O
2KMnO4+H2↑+2KOH。
下列叙述正确的是 ( )
A.在反应②中K2MnO4作氧化剂
B.每生成1mol KMnO4共转移6mol电子
C.第②步电解时,阴极周围溶液的pH减小
D.第②步电解时,KMnO4在阳极区生成
第Ⅱ卷(必做120分+选做32分,共152分)
|
[必做部分]
14.下列反应中符合下图图象的是( )
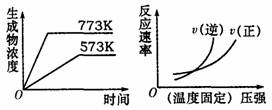
 A.N2(g) +3H2(g) 2NH3(g)
A.N2(g) +3H2(g) 2NH3(g)
△H=-Q1kJ·mol-1(Q1>0)
 B.2SO3(g)
2SO2(g)+O2(g)
B.2SO3(g)
2SO2(g)+O2(g)
△H=+Q2kJ·mol-1(Q2>0)
 C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
△H=-Q3kJ·mol-1(Q3>0)
 D.H2(g) +CO(g) C(s)+H2O(g)
D.H2(g) +CO(g) C(s)+H2O(g)
△H=+Q4kJ·mol-1(Q4>0)
13.把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,反应前及反应一段时间后各物质的质量见下表:
|
|
A |
B |
C |
D |
|
反应前质量/g |
19.7 |
8.7 |
23.6 |
0.4 |
|
反应后质量/g |
待测 |
17.4 |
2 |
3.6 |
下列说法不正确的是 ( )
A.此反应一定不是可逆反应
B.物质C一定是化合物
C.此反应不一定是氧化还原反应
D.若A、C的摩尔质量之比为97:108,则A、C变化的物质的量之比为1:2
12.如下图所示,在注射器中加入少量Na2SO3晶体,并吸入少量的硫酸(以不接触纸条为准)。则下列有关说法正确的是( )

A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
11.下列说法正确的是 ( )
A.油脂都不能使溴的四氯化碳溶液褪色
B.棉花、蚕丝和人造毛的主要成分都是纤维素
C.无论是乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
D.所有烷烃和糖类中都存在碳碳单键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com