
8.下列说法中,正确的是
A.强电解质的水溶液中不存在溶质分子
B.强电解质溶液一定比弱电解质溶液的导电性强
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量浓度相同,电离程度也相同
7.一定温度下,反应

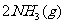 达到化学平衡状态的标志是
达到化学平衡状态的标志是
A.
B.N2、H2和NH3的物质的量分数不再改变
C.N2与H2的物质的量之和是NH3物质的量的2倍
D.单位时间里每增加1molN2,同时增加3molH2
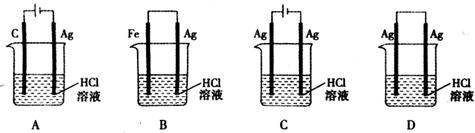
6.某同学为完成反应: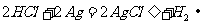 ,设计了如下图所示的四个实验。你认为可行的是
,设计了如下图所示的四个实验。你认为可行的是
5.在一定温度下,向AgCl 饱和溶液中加水,下列叙述正确的是
A.AgCl的溶解度增大 B.AgCl的溶解度、KSP均不变
C.AgCl 的KSP增大 D.AgCl的溶解度、KSP均增大
4.实验室进行中和热的测定的实验装置如下图所示,下列所用的试剂和仪器正确的一组是

A.0.50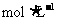 盐酸、0.50
盐酸、0.50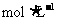 NaOH溶液、100 mL量筒1个
NaOH溶液、100 mL量筒1个
B.0.50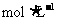 盐酸、0.50
盐酸、0.50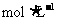 NaOH溶液、100 mL量筒2个
NaOH溶液、100 mL量筒2个
C.0.50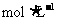 盐酸、0.55
盐酸、0.55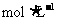 NaOH溶液、50 mL量筒1个
NaOH溶液、50 mL量筒1个
D.0.50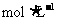 盐酸、0.55
盐酸、0.55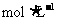 NaOH溶液、50 mL量筒2个
NaOH溶液、50 mL量筒2个
3.反应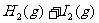

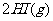 在450℃时,化学平衡常数是49。则反应
在450℃时,化学平衡常数是49。则反应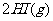

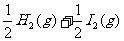 在450℃时的化学平衡常数是
在450℃时的化学平衡常数是
A.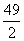 B.
B.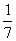 C.7 D.
C.7 D.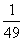
2.据报道,全球每年发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电极反应式中,与铁的电化学腐蚀有关的是
①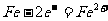 ②
②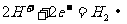 ③
③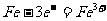 ④
④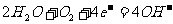 ⑤
⑤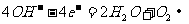
A.①②⑤ B.②③④ C.①③⑤ D.①②④‘
1.化学反应过程中既有物质变化,又有能量变化。下列判断正确的是
A.需要加热才能进行的反应一定是吸热反应,放热反应不需要加热
B.一定条件下进行的化学反应,只能将化学能转化成光能或热能
C.电解质导电的过程实际是一个电解的过程,此过程中电能转化成化学能
D.电镀是利用原电池的原理,在易被腐蚀的金属表面包上一层不易被腐蚀的金属薄片
21.(6分)
某温度(t℃)时,水的KW= ,则该温度 25℃(填大于、小于或等于)。将此温度下pH=11的NaOH的溶液
,则该温度 25℃(填大于、小于或等于)。将此温度下pH=11的NaOH的溶液 L与pH=1的H2SO4溶液
L与pH=1的H2SO4溶液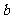 L混合。
L混合。
(1)若所得混合液为中性,则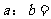
(2)若所得混合液的pH=2,则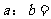
20.(16分)
某化学反应2A B十D在四种不同的条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B十D在四种不同的条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
浓度(mol/L) |
时间(min) |
|||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
|
1 |
温度 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应0至20分钟时间内用A表示该反应的平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应在20分钟内就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为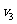 ,实验1的反应速率为
,实验1的反应速率为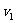 ,则达到平衡时
,则达到平衡时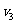
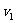 (填“>”、“=”、“<”),且
(填“>”、“=”、“<”),且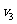 = mol/L。
= mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(填“吸热”、“放热”)。
(5)800℃时,反应2A B十D的平衡常数= ,其他条件不变,B、D的起始浓度为0.50mol/L,A的起始浓度为0,达到平衡时A的浓度为 mol/L。
B十D的平衡常数= ,其他条件不变,B、D的起始浓度为0.50mol/L,A的起始浓度为0,达到平衡时A的浓度为 mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com