
18.0.1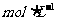 NaHCO3溶液中有关微粒浓度的关系式,正确的是
NaHCO3溶液中有关微粒浓度的关系式,正确的是
A.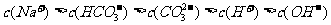
B.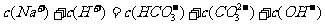
C.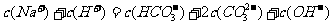
D.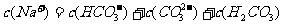
第Ⅱ卷(非选择题 共55分)
17.在室温下等体积混合的酸和碱的溶液,混合后pH>7的是
A.pH=3的硝酸溶液和pH=11的氢氧化钾溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=2的醋酸溶液和pH=12的氢氧化钡溶液
D.pH=3的硫酸溶液和pH=12的氢氧化钠溶液
16.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知: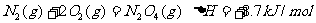 ;
;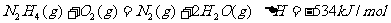 。下列表示肼和N2O4反应的热化学方程式,正确的是
。下列表示肼和N2O4反应的热化学方程式,正确的是
A.
B.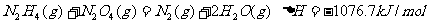
C.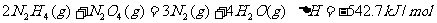
D.
15.一定温度下,某固定容积的密闭容器中发生可逆反应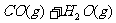

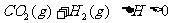 。当反应达到平衡时,测得容器
。当反应达到平衡时,测得容器
中各物质均为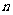 mol。欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施中可采用的是
mol。欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施中可采用的是
A.升高湿度 B.降低温度
C.再通入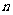 molCO和
molCO和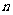 mol H2O(g) D.再通入
mol H2O(g) D.再通入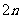 mol CO和
mol CO和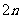 mol H2O(g)
mol H2O(g)
14.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
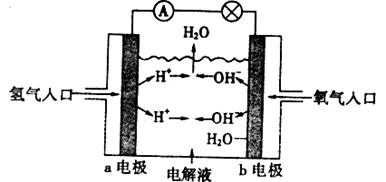
A.a电极是负极
B.b电极的电极反应式为: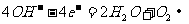
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
13.将纯铜片和纯锌片按如图所示方式插入同浓度的稀硫酸中一段时间后,以下叙述正确的是
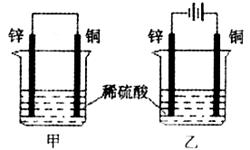
A.两烧杯中铜片均有气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.甲中的锌比乙中的锌腐蚀慢 D.两烧杯中溶液的pH均增大
12.对于热化学方程式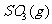
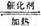
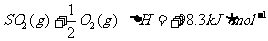 的描述有如下四个图像(
的描述有如下四个图像(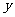 表示SO2的质量分数),其中正确的是
表示SO2的质量分数),其中正确的是
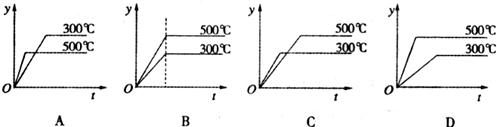
11.下列关于化学平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数K均是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应物浓度无关
D.从平衡常数K的大小可以推断一个反应进行的程度
10.下列事实不能用电化学原理解释的是
A.常温条件下,在空气中铝不容易被腐蚀
B.镀锌铁片比镀锡铁片更耐腐蚀
C.用锌与稀硫酸制氢气时,可向稀硫酸中滴入量CuSO4溶液
D.远洋海轮的尾部装上一定数量的锌块
9.同体积、同浓度的两份NaOH溶液,分别用pH=2和pH=3的醋酸溶液中和,如恰好完全中和时消耗醋酸溶液的体积依次为V1和V2,则两者的关系正确的是
A.V2>10V1 B.V2<10Vl C.V2=10Vl D.Vl=10V2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com