
7.跟100mL0.1mol/(NH4)2 SO4溶液中的NH4+浓度相同的是 ( )
A.01mol/L NH4NO3溶液100ml B.0.2mol/L氨水溶液100ml
C.0.2mol/L(NH4)2 CO3溶液50ml D.0.2mol/LNH4CL溶液200ml
6.下列说法正确的是 ( )
①正常雨水的PH值为7.0;酸雨的PJ小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染;
③使用二氧化硫和某些含硫化合物的进行增白的食品对人体健康产生损害;
④使用氯气对自来水消毒过程中,生成的有机化合物可能对人体有害;
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A.①②③ B.①④⑤ C.②③④ D.③④⑤
25.(10分)水的电离平衡曲线如图所示:
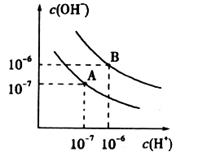
(1)25℃时,纯水的电离平衡状态为A点,当温度升高到100℃时,纯水的电离平衡状态为B点,则此时水的离子积从 增加到 。造成水的离子积增大的原因是 。
(2)25℃时,将pH=10的Ba(OH)2溶液与pH=3的盐酸混合,若所得混合溶液为中性,则Ba(OH)2溶液与盐酸的体积比为 。
(3)100℃时,将pH=8的NaOH溶液与pH=5的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为 。
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸溶液的pH1与强碱溶液的pH2之间应满足的关系是 。
24.(9分)将2molSO2和1molO2混合置于体积可变的密闭容器中,在T1温度下发生如下反应: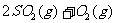

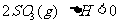 。当反应进行到时间
。当反应进行到时间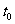 点时达到平衡状态,测得混合气体的总物质的量为2.1mol。试回答:
点时达到平衡状态,测得混合气体的总物质的量为2.1mol。试回答:
(1)该反应的平衡常数表达式: 。
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 。(以上均填增大、减小或不变)
(3)反应进行到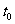 时SO2的体积分数为 。
时SO2的体积分数为 。
(4)若保持温度不变,使用催化剂,在图中作出从反应开始到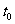 点这段时间SO2物质的量的变化曲线。
点这段时间SO2物质的量的变化曲线。
(4)你同意哪种观点? ,理由是 。
(用化学原理说明,如上述两种观点都不同意,请说明理由)
23.(9分)在课堂上,老师提出“电解CuCl2溶液的过程中pH如何变化”的问题,让同学们展开探究式的讨论。一部分同学依据理论认为:电解CuCl2溶液一段时间后,溶液的pH会升高;另一部分同学持怀疑态度,课后做实验得出如下数据:
|
时间/min |
0 |
10 |
20 |
30 |
60 |
|
PH |
4 |
3 |
2 |
1 |
l |
请回答下列问题:
(1)电解前溶液pH=4的原因是(用离子方程式说明) 。
(2)部分同学认为pH会升高的依据是 。
22.(9分)影响化学反应速率的客观因素有许多,如温度、浓度、压强、催化剂、表面积等,因此探究客观条件与化学反应速率关系的实验设计及改进也就许许多多。某同学设 计了如下实验:
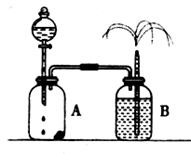
①实验装置如上图所示。取少量(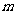 g)粉末状的MnO2,滴加适量水制成团粒状,全部放在广口瓶A里,并尽量靠近瓶壁,分液漏斗里装入3mL 20%的过氧化氢溶液。广口瓶 B中加入2/3容积的水(滴加几滴红墨水以增强实验效果)。
g)粉末状的MnO2,滴加适量水制成团粒状,全部放在广口瓶A里,并尽量靠近瓶壁,分液漏斗里装入3mL 20%的过氧化氢溶液。广口瓶 B中加入2/3容积的水(滴加几滴红墨水以增强实验效果)。
②将广口瓶A中装有二氧化锰的一侧稍垫高些,然后打开分液漏斗的活塞使过氧化氢溶液流入广口瓶中,待液面降至活塞处时关闭活塞。
③将广口瓶A放平,使过氧化氢溶液与二氧化锰接触。
④待反应完毕后,将广口瓶A中的固体物质全部分离出来,称其质量仍为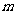 g。通过其它实验证实,该固体完全是MnO2。
g。通过其它实验证实,该固体完全是MnO2。
请结合所学知识回答下列问题:
(1)第②步操作,广口瓶A中的现象为 ,广口瓶B处的现象为 。
(2)第③步操作,广口瓶A中的现象为 ,广口瓶B处的现象为 。
(3)通过该实验,对二氧化锰的作用你能得出的结论是 ,有关反应的化学方程式为 。
21.(6分)反应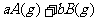

 在容积不变的密闭容器中达到化学平衡,且起始时A与B的物质的量之比为
在容积不变的密闭容器中达到化学平衡,且起始时A与B的物质的量之比为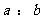 ,则:
,则:
(1)达到平衡后;A、B的转化率之比是 。
(2)达到平衡后,若升高温度,C的质量分数降低,则该反应的正反应是 反应。(填“吸热”或“放热”)
(3)若同等倍数地增大A、B的物质的量浓度,并在原温度下达到平衡时,A与B的转化率也同时增大,则( )与(
)与( )的关系是
)的关系是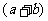
 。(填“>”、“<”、“=”或“无法确定”)
。(填“>”、“<”、“=”或“无法确定”)
20.(6分)锌-锰干电池是普遍使用的化学电池,如图是干电池的基本构造图,其中含有MnO2、NH4Cl、ZnCl2等糊状物。
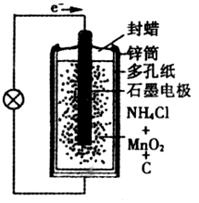
(1)干电池工作时正极上的反应是
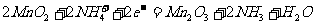 ,则负极上的电极反应式是 。
,则负极上的电极反应式是 。
(2)干电池用久了就会变软,其原因是:① ,② 。
(3)将1L含有0.4molCuSO4和0.2mol NaCl的水溶液用惰性电极电解一段时间后,在一个电极上得到0.2mol Cu,理论上另一电极放出气体的体积是 L(标准状况)。
19.(6分)现有浓度均为0.1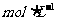 的七种电解质溶液:
的七种电解质溶液:
①HCl ②H2SO4 ③NaOH ④CH3COOH ⑤NH4Cl ⑥NaCl ⑦CH3COONa
(1)上述七种溶液的pH由小到大的顺序是 。
(2)上述七种溶液中,水的电离程度最小的是 。
(3)将上述溶液稀释相同倍数时,其pH不变的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com