
3.下列气体排入大气,不会造成空气污染的是
A.N2 B.SO2 C.NO2 D.NO
2.下列实验现象的描述错误的是
A.氢气在氯气中燃烧发出苍白色火焰
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体
C.二氧化碳气体通入氯化钙溶液中,有白色沉淀生成
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
1.下列物质中,不含有硅酸盐的是
A.水玻璃 B.硅芯片 C.陶瓷 D.普通水泥
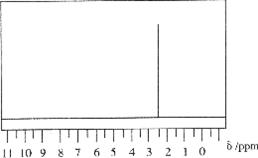
24.(6分)某由碳、氢、氧三种元素组成的有机物,经测定其相对分子质量为46。取该有机物样品4.6g,在纯氧中完全燃烧,并将产物先后依次通过浓硫酸和碱石灰,两者分别增重5.4g和8.8g。
(1)试通过计算确定该有机物的分子式。
(2)若该有机物的1H核磁共振谱图下图所示,请写出该有机化合物的结构简式。
23.(10分)(1)下表是A、B二种有机物的有关信息:

根据表中信息回答下列问题:
①A与溴的四氯化碳溶液反应的生成物的名称是 ;写出在一定条件下,A生成高分子化合物的化学反应方程式 。
②A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n= 时,这类有机物开始出现同分异构体。
③B具有的性质是 (填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: 。
(2)二噁英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为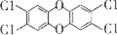 ,它的分子式为
,它
芳香族化合物(填“属于”或“不属于”)
,它的分子式为
,它
芳香族化合物(填“属于”或“不属于”)
22.(10分)现有25℃时0.1mol·L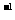 的氨水。请回答以下问题:
的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中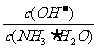 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式
;所得溶液的pH 7(填“>”、“<”或“=”),用离子方程式表示其原因 ;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a
mol·L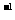 ,则c(SO4
,则c(SO4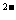 ) ;
) ;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是 。
21.(12分)实验室制取甲酸乙酯的反应为:
HCOOH+CH3CH2OH HCOOCH2CH3+H2O
HCOOCH2CH3+H2O
反应在该条件下进行时各物质的浓度(mol·L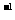 )随时间的变化如下表:
)随时间的变化如下表:
|
时间(min) |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
|
0 |
0.3 |
0.7 |
0 |
0.3 |
|
10 |
0.23 |
a |
b |
c |
|
20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3KPa时沸点如下:
|
|
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
|
沸点(℃) |
101 |
78.5 |
54 |
100 |
(1)写出该反应的平衡常数表达式K= 。能否由题给条件判断K值随温度变化是增大还是减小 (选填“能”或“不能”)。
(2)表中,a=
mol·L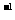 。50℃时,K=
。50℃时,K=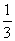 ,在20min时,反应是否达到平衡 (选填“是”或“否”)。
,在20min时,反应是否达到平衡 (选填“是”或“否”)。
(3)在10-20min时,用乙醇表示的平均反应速率为
mol·L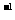 ·min
·min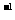 。该反应速率比0-10min的平均反应速率小,其原因是
。该反应速率比0-10min的平均反应速率小,其原因是
。
(4)在起始浓度相同的情况下,要提高甲酸乙酯的产率,可采取的措施是
。
20.(6分)氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请解答下列问题:
(1)由氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2(g)+3H2(g)F 2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4 kJ。①请写出该反应的热化学方程式 。常温下,将10mol N2和30mol H2放入合成塔中,充分反应,则放出的热量 (填“等于”、“大于”或“小于”)924 kJ。
2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4 kJ。①请写出该反应的热化学方程式 。常温下,将10mol N2和30mol H2放入合成塔中,充分反应,则放出的热量 (填“等于”、“大于”或“小于”)924 kJ。
②如果一个反应的△H-T△S<0,则该反应能够自发进行。已知该反应的△S= 一198.2J·K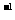 ·mol
·mol 。请判断上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
。请判断上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
(2)Marnellos和Stoukides发明了电化学制备氨气方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传递H+,这种方法实现了高温常压下高转化率的电化学合成氨。已知阳极发生的电极反应为:H2一2e =2H+,则阴极的电极反应式为
=2H+,则阴极的电极反应式为
。
19.(12分)某化学兴趣小组利用细废铁屑制取FeCl3·6H2O晶体。主要步骤如下:
①洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤;
②按下图组装仪器,并检查装置的气密性,然后将①得到的滤液放入试剂瓶B中;
③将石墨电极X、Y连接上直流电源,通电,待FeCl2全部被氧化后,断开电源;
④试剂瓶B中的溶液经过一系列实验操作,可得到FeCl3·6H2O晶体。
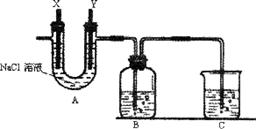
请回答下列问题:
(1)A中的X极应连接电源的 极,
A中发生反应的化学方程式是 ;
B中溶液颜色的变化是 ;
B中反应的离子方程式是 。
(2)烧杯C中应盛放的试剂是 ,
其作用是 。
(3)试剂瓶B中的溶液由步骤④制得FeCl3·6H2O晶体,步骤④需要进行的实验操作依次是(填序号)
A.蒸发浓缩 B.洗涤 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是
。
18.mA(s)+nB(g) qC(g)△H<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是
qC(g)△H<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是

A.n>q B.X点时的状态,V(正)<V(逆)
C.m+n<q D.X点比Y点混和物的正反应速率慢
第Ⅱ卷 (非选择题 共56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com