
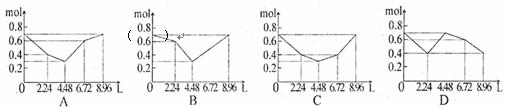
13.往含0.2mol NaOH和0.1molBa(OH)2的溶液中持续稳定地通入SO2气体,当通入气体为8.96L(0℃,1.01×105Pa)时立即停止,如下图所示。则这一过程中,溶液中总离子的物质的量和通入SO2气体的体积关系正确的图像是(气体的溶解和离子的水解都忽略不 计) ( )
第Ⅱ卷(共10小题,共174分)
12.下列各组物质在一定条件下充分反应后,生成气体的物质的量肯定不小于1mol的是
( )
A.0.4L 10mol·L-1的浓盐酸与足量MnO2反应
B.2mol H2O(g)和CO2混合气体与足量的Na2O2反应
C.1mol Cu与200g98%的浓硫酸反应
D.56g Fe与足量的浓硝酸反应
11.离子检验的常用方法有三种:
|
检验方法 |
沉淀法 |
显色法 |
气体法 |
|
含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法组合完全正确的是 ( )
①NH+4-气体法 ②SO2-4-沉淀法 ③Fe3+-显色法 ④I--显色法
⑤Ca2+-气体法 ⑥OH--沉淀法
A.①②③④ B.①②⑤⑥ C.③④⑤⑥ D.②③④⑥
9.下列化学用语表述正确的是 ( )
A.碳酸氢钠溶液与少量氢氧化钡溶液混合的离子方程式:
HCO-3+Ba2++OH- === BaCO3↓+H2O
B.101Kpa时,2g辛烷完全燃烧生成二氧化碳气体和液态水,放出96.8kJ热量,则下列表示辛烷燃烧热的热化学方程式:
C8H18(I)+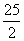 O2(g)=== 8CO2(g)+9H2O(l);△H=-3243.14kJ·mol-1
O2(g)=== 8CO2(g)+9H2O(l);△H=-3243.14kJ·mol-1
C.H2O2的结构式H-O-O-H,NH4Cl的电子式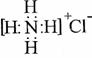
D.氢氧燃料电池负极反应式:H2 === 2H++2e-;电解饱和食盐水的阴极反应式:
2H+ === H2↑-2e-
|
A.离子半径:Na+>Mg2+>Al3+>Cl- 原子半径:Na>Mg>Al>Cl
B.稳定性:HF>H2O>NH3>CH4 键长:HF<H2O<NH3<CH4
C.碱性:CsOH>KOH>Mg(OH)2>NaOH 金属性:Cs>K>Mg>Na
D.氧化相同物质的量I-生成I2,需要氧化剂物质的量 MnO-2>H2O2>O3>Cl2 氧化性: MnO-4>H2O2>O3>Cl2
8.阿伏加德罗常数用NA表示,下列叙述正确的是 ( )
A.2.24LCO2中含有原子数为0.3NA
B.0.1L 3mol·L-1的Na2CO3溶液中含有CO2-3数目为0.3NA
C.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
D.125g CuSO4·5H2O晶体中含有0.5NA个Cu2+
7.下列有关化工生产的说法正确的是 ( )
A.合成氨、接触法制硫酸工业中都应用了高温、高压、催化剂为条件
B.三峡大坝使用了大量水泥,水泥属于一种新型无机非金属材料
C.接触法硫酸工业中,炉气进入接触室之前需要净化、干燥,因为炉气中的杂质易与SO2反应
D.工业“三废”的综合利用不仅减少污染,还获得有用的副产品
6.下列说法正确的是 ( )
A.稀有气体形成的晶体属于分子晶体
B.原子晶体不可能含有极性共价键
C.冰→水→水蒸气的过程中存在化学键的断裂
D.金属元素和非金属元素形成化合物一定是离子化合物
34.化学选考题(15分)
A.[化学--选修化学与技术]
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
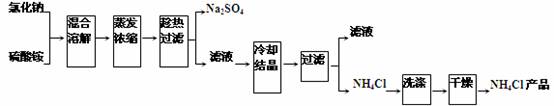
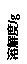

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需 NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
B.[化学选修--物质结构与性质]
现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
单质能与水剧烈反应,所得溶液呈弱酸性 |
|
X |
L层p电子数比s电子数多2个 |
|
Y |
第三周期元素的简单离子中半径最小 |
|
Z |
L层有三个未成对电子 |
(1)写出元素X的离子结构示意图 。写出元素Z的电子排布式
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 (用元素符号表示),理由 。
C.[化学选修--有机化学]
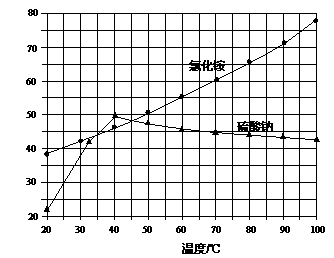
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下:
这种材料可采用如下图所示的合成路线
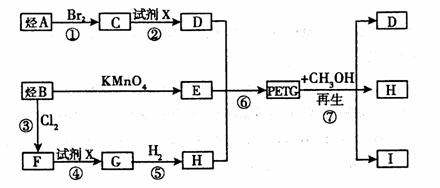
(1) 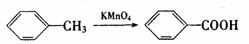
(2)RCOOR1+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1)⑦的反应类型是
(2)写出I的结构简式:
(3)合成时应控制的单体的物质的量:n(H):n(E): n (D)= (用m、n表示)。
(4)写出反应②的化学方程式:
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。 、 、 。
29.(13分))将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g); ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
2HI(g); ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
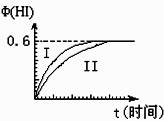
(1)达平衡时,I2(g)的物质的量浓度为 mol·L-1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线
(I)所示,则该条件可能是 (填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为 (用一个含a、b、c的代数式表示)。
(4)室温时将0.01 mol HI气体溶于水配成100 ml溶液,则该溶液中由水电离产生的氢离子的物质的量浓度为 mol·L-1 ;若降低温度该溶液的pH值将 (填增大、减小或不变)
选做题(以下三题A、B、C小题自选一题作答,多做不给分)
28.(15分) 22.(18分)A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如下图所示转化关系(这些转化关系都不需要使用催化剂)。
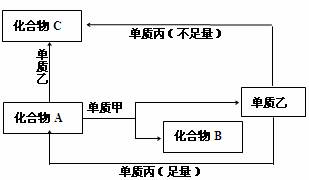
请回答下列问题:
(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属单质,丙可以使带火星的木条复燃,且甲、乙、丙由短周期元素组成。则A的结构式是 ,
A与甲反应的化学方程式是 。
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中只有甲由短周期元素组成,且乙与甲同主族,与丙同周期,乙是常温下唯一的液体非金属单质,也有强氧化性。通常条件下反应都在溶液中进行。则:
①单质丙是(写元素符号) 。
②A与乙反应的离子方程式为 。
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,并符合上图所示,则A的溶液跟甲反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com