
8.下列反应的离子方程式书写正确的是 ( )
A.将Al条投入稀硝酸溶液中:2Al+6H+====2Al3++3H2↑
B.向碳酸氢钙溶液中加入少量的氢氧化钠溶液:
Ca2++2HCO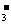 +2OH
+2OH ====CaCO3↓十CO
====CaCO3↓十CO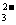 十2 H2O
十2 H2O
C.氨水与三氧化铁溶液反应:3OH +Fe3+====Fe(OH)3↓
+Fe3+====Fe(OH)3↓
D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的乙酸:
CO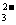 +CH3COOH====CH3COO一+HCO
+CH3COOH====CH3COO一+HCO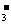
7.设NA为阿佛加德罗常数,下列叙述中不正确的是 ( )
A.18 g NH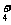 中所含的电子数为10NA
中所含的电子数为10NA
B.0.1mol Fe与足量的I2充分反应,转移的电子数为0.2NA
C.标准状况下,1 L辛烷完全燃烧产生8L的CO2
D.28g C3H6与C2H4的混合物完全燃烧可生成88g CO2
6.下列化学实验不符合“绿色化学”要求的是 ( )
A.在萃取操作的演示实验中,将CCl4萃取溴水中的溴改为CCl4萃取碘水中的碘
B.在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
C.将实验室的废酸液和废碱液中和后再排放
D.将实验室用KMnO4加热分解制氧气后的残余物倒入下水道
5.下列说法正确的是 ( )
A.O3和O2互为同位素
B.HF、HCl、HBr、HI熔点、沸点依次升高
C.等质量的O3和O2含有相同的质子数
D.O3和O2的相互转化是物理变化
4.下列物质性质的变化规律,与共价键的强弱有关的是 ( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.Li、Na、K、Rb、Cs的熔点、沸点逐渐降低
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.KF、KCl、KBr、KI的熔点依次降低
2.在加入铝粉产生氢气的溶液中,下列各组离子可能大量共存的是 ( )
A.NH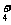 、NO
、NO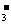 、CO
、CO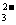 、Na+ B.Ba2+、Mg2+、HCO
、Na+ B.Ba2+、Mg2+、HCO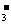 、Na+
、Na+
C.H+ 、F一、K+ 、Cl- D.K+ 、AlO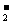 、OH一、NO
、OH一、NO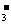
|
|
|
|
C.碳-12原子: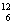 C D.Ar原子的结构示意图为:
C D.Ar原子的结构示意图为:
1.下列说法正确的是 ( )
A.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
B.废弃的塑料、金属、纸制品及玻璃等都是可回收再利用的资源
C.凡含有食品添加剂的食物对人体健康均有害,不宜食用
D.某些不合格大理石装潢材料中含有严重超过规定标准,对人体有害的放射性同位素氡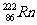 ,其原子中的质子数为136
,其原子中的质子数为136
22.B.(12分)(实验化学)硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
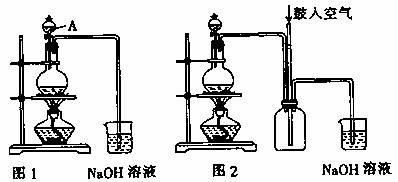
(1)图1烧瓶中发生的反应的离子反应方程式为: 。
(2)图2是图1的改进装置,其优点有:
① ;
② 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3-4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,晶体采用酒精淋洗的优点是 。
④上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 、
、
。
22.A.(12分)(物质结构与性质)
(1)原子数目和电子总数(或价电子总数)相同的微粒互称等电子体,等电子体具有相似的结构特征。试写出短周期元素形成的含有14个电子的分子的化学式: ,其中 和 互为等电子体,CO分子的电子式为 。
(2)CH3CHO分子中,-CH3中的碳原子采用 杂化方式,-CHO中的碳原子采取 杂化方式。
(3)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为 。

21.(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。已知反应N2+3H2 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值: 。
|

(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g) CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g) 2H2O(1) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) △H3 =-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com