
1.月球土壤中吸附着数百万吨的 ,每百吨
,每百吨 核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于
核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于 的说法正确的是( )
的说法正确的是( )
A. 原子核内含有2个中子
原子核内含有2个中子
B. e原子核内含有3个质子
e原子核内含有3个质子
C. 原子核外有3个电子
原子核外有3个电子
D. 和
和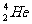 是两种不同的核素
是两种不同的核素
25.(7分)某工厂实验室用一氧化碳和氢气制备甲醇,其原理为:
 CO(g)+2H2(g) CH3OH(g)△H<0。
CO(g)+2H2(g) CH3OH(g)△H<0。
试回答下列问题:
(1)若该反应在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”“=”或“<”);
(2)在恒温恒容条件下,判断该反应达到化学平衡状态的依据是 (填序号);
A.v(H2)逆=2v(CH3OH)正 B.v(H2)逆=v(CO)正
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)某温度时,向一定容积的密闭容器中充入CO和H2,浓度分别为1mol·L-1、2mol·L-1,达到平衡时CO的浓度为0.6mol·L-1。试求该温度下的化学平衡常数。
24.(8分)某化学课外活动小组,从化学手册上查得硫酸铜在500℃以上可以分解生成氧化铜、二氧化硫、三氧化硫和氧气,于是设计一验证性实验,探索测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系。实验用到的仪器如下图所示:
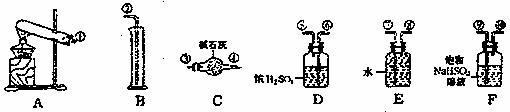
实验测得的数据及有关结果如下:
①准确称取2.4g无水CuSO4;
②干燥管的总质量在实验结束时增加了1.28g;
③测出量筒中水的体积后,折算成标准状况下气体的体积为112mL。
试回答下列问题:
(1)装置C的作用是 ;
装置F的作用是 ;
(2)按装置从左至右的方向,各仪器接口的连接顺序为 ;
(3)反应产生的O2的物质的量为 ,SO3的物质的量为 ;
(4)硫酸铜分解的化学方程式为 。
23.(8分)间接碘量法测定胆矾中铜含量的原理和方法如下:
原理:①在酸性条件下,Cu2+与I-作用可生成I2
 ②I2+I-
I3-
②I2+I-
I3-
③I3-+2S2O32- S4O62-+3I-
已知氧化性:Fe3+>Cu2+>I2>FeF63-;Fe3++6F-===FeF63-
操作:准确称取ag胆矾试样[含少量Fe2(SO4)3],置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL 3mol·L-1H2SO4溶液、少量NaF(足量),再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入指示剂,用c mol·L-1Na2S2O3标准溶液滴定至终点,共用去vmL标准溶液。
回答下列问题:
(1)实验中,加KI前需加入少量NaF,其作用是 ;
(2)滴定实验中所用指示剂是 ;
(3)本实验中用碘量瓶而不用普通锥形瓶是因为 ;
(4)硫酸铜与碘化钾反应后,Cu2+被还原并生成白色的碘化亚铜沉淀,该反应的离子方程式为 ;
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= 。
22.(8分)已知A的化学式为Fe3C。A-K存在如下转化关系(部分产物及反应条件已略去):
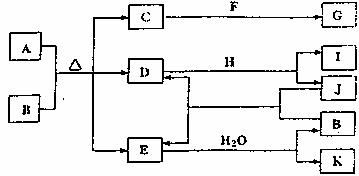
其中E为红棕色气体,F、H为金属单质,J为固态非金属单质。B与F反应时可生成C,也可生成G。
试回答下列问题:
(1)写出下列物质的化学式:C ,H ,K ;
(2)B的稀溶液与F生成G的离子方程式为 。
21.(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其它组的实验结果,仅从甲组情况分析,如何用a的大小来说明HA是强酸还是弱酸 ;
(2)不考虑其它组的实验结果,仅从乙组情况分析,c是否一定等于0.2 (填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 (填序号);
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 ;
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算):
c(Na+)-c(A-) = mol·L-1,
c(OH-)-c(HA) = mol·L-1。
19.(7分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。
据此回答:
(1)化合物XN为 (写化学式);
(2)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,组成元素的原子数目之比为1∶1∶1,且两种物质的水溶液均呈碱性,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为 ,B的化学式为 ;
(3)工业上制取单质M的化学方程式为 。
20(8分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生如下反应:
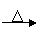
 A.甲+H2O 乙(白色沉淀)+丙
B.乙 氧化物+H2O
A.甲+H2O 乙(白色沉淀)+丙
B.乙 氧化物+H2O
①b反应的化学方程式为 ;
②单质R与金属镁用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极的电极反应式为 。
 (2)若甲、乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
丙。则:
(2)若甲、乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
丙。则:
①甲的电子式为 ;丙的化学式为 ;
②写出在200mL 2 mol·L-1的NaOH溶液中通入6.72L(标准状况)的气体甲发生反应的总离子方程式 。
|
实验编号 |
HA的浓度/(mol·L-1) |
NaOH的浓度/(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
2.答卷前将密封线内的项目填写清楚。
第Ⅱ卷共7个小题。
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试卷中(除题目有特殊规定外)。
18.现有下列三个图像:
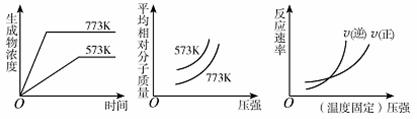
下列反应中全部符合上述图像的反应是 ( )
 A.N2(g)+3H2(g) 2NH3(g);△H<0
A.N2(g)+3H2(g) 2NH3(g);△H<0
 B.2SO3(g) 2SO2(g)+O2(g);△H>0
B.2SO3(g) 2SO2(g)+O2(g);△H>0
 C.4NH3(g)+5O2(g) 4NO+6H2O(g);△H<0
C.4NH3(g)+5O2(g) 4NO+6H2O(g);△H<0
 D.H2(g)+CO(g) C(s)+H2O(g);△H>0
D.H2(g)+CO(g) C(s)+H2O(g);△H>0
第Ⅱ卷(非选择题 共54分)
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com