
1.在春节联欢晚会等舞台上人工制造云雾缭绕的方法是 ( )
A.燃烧白磷 B.燃烧镁粉
C.释放干冰 D.浓盐酸和浓氨水同时喷酒
29.(10分)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是________________________________________________________________。
(4)已知:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是_______________________
_______________________________________________________________________
______________________________________________________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________________________________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时__________先液化。
28.(10分)
一氯乙酸(ClCH2COOH)是无色晶体,可溶于水,其水溶液显酸性,是重要的有机反应中间体,可进行多种反应。
(1)一定条件下,一氯乙酸与苯可直接合成苯乙酸,其反应方程式是______________________ (不要求标出反应条件)。
(2)工业上将一氯乙酸、2–丙醇与浓硫酸混合加热制备一氯乙酸异丙酯,一氯乙酸异丙酯的结构简式为____________________________________ ;反应过程中,可能产生的有机副产物有异丙醚[(CH3)2CHOCH(CH3)2]和________________________(填结构简式)。
(3)pKa常用于表示物质的酸性强弱,pKa的数值越小,该物质的酸性越强。已知卤素原子对饱和脂肪酸的酸性影响具有相似性。25℃时一些卤代饱和脂肪酸的pKa数值如下:
|
卤代酸 |
F3CCOOH |
Cl3CCOOH |
F2CHCOOH |
FCH2COOH |
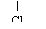 CH3CH2CHCOOH CH3CH2CHCOOH |
|
pKa |
0.23 |
0.65 |
1.24 |
2.66 |
2.85 |
|
卤代酸 |
ClCH2COOH |
BrCH2COOH |
ICH2COOH |
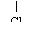 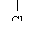 CH3CHCH2COOH CH3CHCH2COOH |
CH2CH2CH2COOH |
|
pKa |
2.86 |
2.90 |
3.18 |
4.06 |
4.52 |
可见,25℃时卤素原子对卤代饱和脂肪酸的酸性影响有(写出2条即可):
①____________________________________________________________________;
②____________________________________________________________________;
根据上述数据和规律判断, Cl2CHCOOH的pKa的数值范围为_________________。
27.(10分)
近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段。
(1)柴油是含C15~C18的碳氢化合物的混合物,这些碳氢化合物属于有机物中的______类。
(2)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X的结构简式是_________________。
(3)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y 含有官能团的名称是_________。在浓硫酸作用下,乙醇与Y反应可生成一种有香味的物质W,化学方程式为________________________________________________________________ 。
(4)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是__________ 或_____________。
(5)工业上通过乙烯与水在一定条件下反应制得乙醇,反应类型是______________;现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷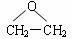 , 该反应的原子利用率为100%,反应的化学方程式为____________________________________________
。
, 该反应的原子利用率为100%,反应的化学方程式为____________________________________________
。
26.(11分)
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g) CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是_______________________________________________
__________________________________________________________________
_____________________________________________________________。
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转 化率 (%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:___________________________________________________________
____________________________________________________________________。
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
|
组别 |
体积分数(%) |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。
25.(10分)
溴酸钾(KBrO3)为白色晶体,是一种常用的氧化剂和分析试剂,加热到370℃分解为溴化钾和氧气。用氯气生产溴酸钾的工艺流程如下:
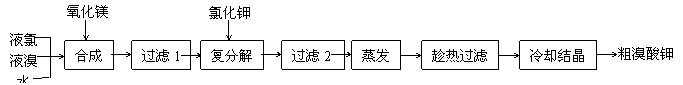
(1)“合成”过程所发生的反应中,氧化剂是___________,还原剂是___________。反应的化学方程式为______________________________________________________。
(2)“复分解”过程中反应的化学方程式为_______________________________。
(3)上述流程中第二次过滤的滤渣主要成分是________________。
(4)“趁热过滤”过程中“趁热”的原因是_________________________________________。
(5)溴酸钾具有毒性,食用少量即可引起呕吐和肾脏的损伤。然而美、日等国都允许在油炸薯片中添加一定量溴酸钾,以改善薯片的口感。我国也曾允许用作烘焙面包的添加剂,但已于2005年7月开始全面禁止在食品中使用溴酸钾。2007年,一批来自美国的油炸薯片在珠海口岸被我国有关部门检出含有溴酸钾而被禁止入境。从化学原理分析推测,有关国家认为在油炸薯片中添加溴酸钾是“安全”的理由是(用化学方程式表示)______________________________________________,而我国认为不安全的理由是_______________________________________________________________。
24.(10分)
以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
① 为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
② 为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为_______________(填化学式)而除去。
(2)①中加入的试剂应该选择_________为宜,其原因是________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是___________________________。
(5)基于假设②,结论是___________________________________________,请设计实验进一步验证该结论,叙述实验操作:_____________________________________
______________________________________________________________________。
23.(9分)
聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%-34%)、SiO2(40%-50%)、Fe2O3(0.5%-3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:

根据流程图回答下列问题:
(1)“煅烧”的目的是______________________________________________________。
(2)配制质量分数15%的盐酸需要200mL30%的浓盐酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(3)“溶解”过程中发生反应的离子方程式为__________________________________
___________________________________________________。
(4)加少量铝粉的主要作用是_____________________________________。
(5)“调节溶液pH在4.2-4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90-100℃,控制温度的实验方法是_________________。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com