
2. 用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
B. 在标准状况下,2.24L CHCl3所含共价键数为0.4 NA
C. 0.05mol 碳酸钠晶体中含离子总数大于0.15 NA
D. 常温下16g O2与O3的混合气体中含氧原子数为NA
1. 离子反应、复分解反应、置换反应和氧化还原反应之间可用下列集合关系表示,其中正确的是


(二)下列有关化学实验的基本操作及安全知识的叙述,不正确的是 (填序号)。
A.用托盘天平称取10.55g干燥的NaCl固体
B.附着于试管内壁的苯酚,可用碱液洗涤
C.用碱式滴定管量取20.00mL 0.1000mol/L的高锰酸钾溶液
D.用渗析法分离淀粉中混有的NaNO3杂质
E.配制浓硫酸的浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.实验时,不慎打翻燃着酒精灯,可立即用湿抹布盖灭焰
H.用重结晶法可以除去硝酸钾中混有的少量氯化钠
I.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
J.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
29.(20分)(一)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
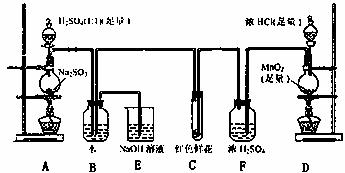
请回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、 。
(2)实验开始后,写出B中反应的离子方程式 。
(3)C中的现象是 ,E装置的作用是 。
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3%,则原样品中Na2SO3的纯度为 (精确到0.1%)。

(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复 操作,若该学生没有重复该操作则测定的结果将 (填“偏高”、“偏低”或“无影响”)。
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃 处酒精灯(填装置字母)。
28.(19分)有机化合物A(C5H8O2)不溶于水,并可以发生如下图所示的变化:
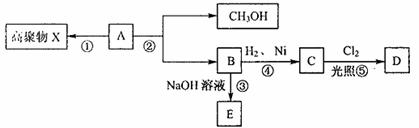
已知:C的一氯代物D只有两种。请回答:
(1)A分子中含有的官能团的名称 。
(2)①②④⑤反应中属于取代反应的有 (填序号)。
(3)C的结构简式 ,X的结构简式 。
(4)写出②的反应方程式 。
(5)C的同分异构体中属于酯类的有 种,写出其中两种的结构简式
、 。
(6)简述验证D中含有氯元素的方法
。
(7)17.2gB与足量的碳酸氢钠溶液反应,标准状况下生成二氧化碳的体积为 L。
27.(9分)A、W为金属单质,B、X、Y为非金属单质,B与W反应生成棕黄色烟E,D、Z为生活必须物质,相互关系如下图。
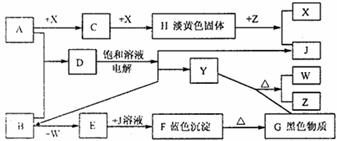
请回答:
(1)写出C的化学式: 。
(2)写出Y+G→W+Z的化学反应方程式,并标明电子转移的方向和数目:
(3)写出电解D的饱和水溶液的离子方程式: 。
(4)用电子式表示Z的形成过程: 。
26.(7分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外层电子数是Y和Z两元素原子最外层电子数的总和;Y元素原子最外层电子数是它的电子层数的2倍;X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是 ;Y的原子结构示意图是 ;Z元素单质常温时的颜色 。
(2)写出工业上制XZ3的化学反应方程式 。
(3)写出X元素最高价含氧酸酸酐的化学式 。
(4)写出Y元素最高价氧化物对应水化物的化学式 。
25.用98%的浓H2SO4(密度为1.84g/mL)1mol·L-1的H2SO4100mL,配制过程中可能用下到列仪器:
①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃管。按使用的先后顺序排列正确的是 ( )
A.②⑥③⑦⑤ B.④③⑤⑦⑥ C.①③⑦⑤⑥ D.②⑤⑦⑥
第Ⅱ卷(非选择题,共55分)
|
24.中央电视台《生活315:排毒基真能排毒吗》的节目中报道,一种名叫“排毒基强离子排毒仪”的产品正在市场热销。该仪器像一个普通电动脚盆,使用时往注满水的盆中放入双脚,加一些精盐,通电启动仪器,过一段时间,盆中开始出现绿色、红褐色的絮状物。下列说法正确的是 ( )
A.绿色、红褐色的絮状物质就是从脚底排出的体内毒素
B.绿色、红褐色的絮状物质是氢氧化亚铁和氢氧化铁
C.此电动脚盆仪器一定是用惰性电极制成的
D.往注满水的盆中加一些精盐的目的是降低溶液的导电性
23.下表为四种溶液的溶质质量分数和物质的量浓度的数值 ( )
|
溶液 |
KOH |
HNO3 |
CH3COOH |
HCl |
|
溶质质量分数ω(%) |
56 |
63 |
60 |
36.5 |
|
物质的量浓度c(mol/L) |
14.3 |
13.8 |
10.6 |
11.8 |
根据表中数据判断上述四种溶液中的密度最小的是 ( )
A.HCl B.HNO3 C.CH3COOH D.KOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com