
28.有机玻璃是甲基丙燃酸甲酯的聚合物,已知烯烃可被酸性高锰酸钾溶液氧化成二元醇,如:
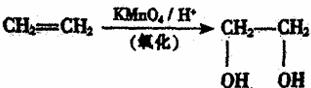
现以2-甲基丙烯为原料,通过下列合成路线制取有机玻璃。
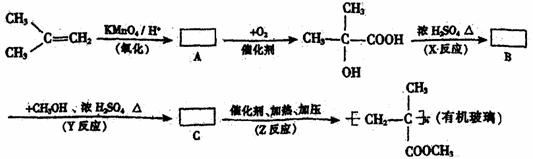
请回答下列问题:
(1)写出结构简式:
A: ;B: ;C: 。
(2)写出反应类型:
X反应 ;Y反应 ;Z反应 。
27.往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃剂Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
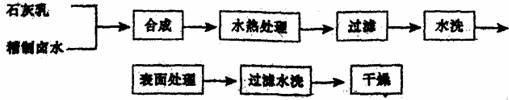
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-nCln·mH2O],反应的化学方程式为 。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:
Mg(OH)2-nCl·mH2O→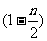 Mg(OH)2+
Mg(OH)2+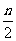 MgCl2+mH2O
MgCl2+mH2O
水热处理后,过滤、水洗。
①检验滤液中含有Cl-的方法是 。
②水洗的目的是 。
(3)阻燃剂Mg(OH)2具有晶粒大、易分散、与高分子材料相溶性好等特点。上述工艺流程中与此有关的步骤是 。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJ
Al(OH)2(s)→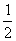 Al2O3(s)+
Al2O3(s)+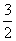 H2O(g)-87.7kJ
H2O(g)-87.7kJ
①Mg(OH)2和Al(OH)2都能起阻燃作用,其主要原因是 。
②等质量Mg(OH)2和Al(OH)2相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:卤系,如四溴乙烷;磷系,如磷酸三苯酯;无机类,主要是Mg(OH)2和Al(OH)2。从环保的角度考虑,应用时较理想的阻燃剂是 类,
原因是 。
26.(B)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如右图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。
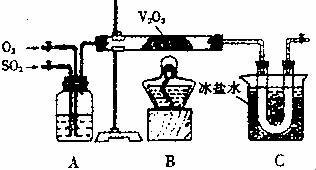
试回答:
(1)A装置可用来观察二氧化硫和氧气的进气量。实验时应使A中两根导气管冒出气泡的速率相等,其目的是 ,A中的药品是 。
(2)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是 。
(3)在实验过程中不能持续加热的理由是 。
(4)C装置用来收集三氧化硫,其中冰盐水的作用是 ;若用ag铜跟足量浓硫酸反应制二氧化硫,实验结束时得到bg三氧化硫,则该实验中二氧化硫的转化率不小于 。
(5)为了减轻实验对环境的污染,请你设计尾气处理装置(用简要文字说明):
。
26.(A)某学生实验兴趣小组拟用图1装置来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验。
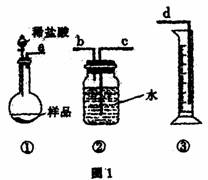
(1)各仪器接口连接顺序是 (用接口字母填写)。
(2)该装置连接好未装药品前,检验气密性的操作是 。
(3)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有 (填序号)。
A.将装置①中稀盐酸换成稀硫酸,装置②中水面上滴加少量植物油
B.将装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液
C.将装置①中稀盐酸换成稀硫酸,装置②中水换成饱和Na2CO3溶液
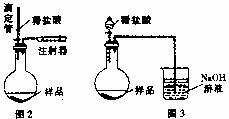
(4)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置。假定滴定管起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为 (用含V1、V2、V3、m的式子表示)。
25.氮气和氢气在一定条件下在一密闭容器中发生如下反应:
 N2(g)+3H2(g) 2NH3(g)+Q
(Q>0)。
N2(g)+3H2(g) 2NH3(g)+Q
(Q>0)。
(1)写出该反应的化学平衡常数表达式
。
(2)降低温度,该反应的K值 ,
化学反应速率 ,氨气的百
分含量 (以上均填“增大”、“减小”或“不变”)。
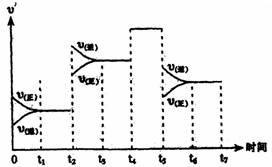
(3)上图表示上述反应在某一时间段中反应速率与反应过程的关系图。据图判断氨的百分含量最高的一段时间是 。
(4)据图判断反应在t2~t3这段时间内,曲线变化的原因是 (用文字表达),
t5~t6时间内曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.扩大容器的体积 c.降低温度 d.增加了NH3的量
(5)丙同学改用图3装置,通过测定烧杯中NaOH溶液的增重来确定样品中NaHCO3的含量。你认为乙、丙两同学的方案中更合理的是 ,理由是
。
24. NaNO2大量用于染料工业和有机合成工业中。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须经处理后才能排放。处理方法如下:
NaNO2大量用于染料工业和有机合成工业中。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须经处理后才能排放。处理方法如下:
 NaNO2+ KI+ → NO+
I2+
K2SO4+ NaSO4+
NaNO2+ KI+ → NO+
I2+
K2SO4+ NaSO4+
(1)请完成该化学方程式,配平并标出电子转移的方向和数目。
(2)在上述反应中,若要生成15gNO,则电子转移了 个。
(3)在上述反应中,硫酸体现了 性质。
(4)用上述反应来处理NaNO2并不是最佳方法,其原因是生成了 ,该物质会造成 。从环保角度讲,要处理NaNO2所用的物质的 (填“氧化性”或“还原性”)应该比KI更 (填“强”或“弱”)
23.(B)A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧的产物可使品红溶液褪色:F和C元素形成的化合物F3C4具有磁性;A的单质在C2中燃烧可生成AC和AC2两种气体;D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)F元素在周期中的位置是 。
(2)AC2的结构式为 ;DC的电子式为 。
(3)元素C与元素E相比,非金属性较强的是 (用元素符号表示)能证明这一事实的是 。
(4)EC2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体BC,有关反应的离子方程式为 ,由此可知BC和EC2还原性较强的是(写化学式) 。
23.(A)A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧的产物可使品红溶液褪色:F和C元素形成的化合物F3C4具有磁性;A的单质在C2中燃烧可生成AC和AC2两种气体;D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)F元素在周期中的位置是 。
(2)AC2的结构式为 ;DC的电子式为 。
(3)元素C与元素E相比,非金属性较强的是 (用元素符号表示)能证明这一事实的是 。
(4)A、B、C形成的10电子氢化物中,A、B的氢化物沸点较低的是(写化学式)
;B、C的氢化物分子结合H+能力较强的是(写化学式)
,用离子方程式加以说明 。
22.有6g含杂质的Na2SO3与足量的盐酸反应,得气体1.12L(标准状况),且该气体的平均相对分子质量为60,则此杂质可能是 ( )
A.Na2CO3 B.NaHCO3
C.Na2CO3和NaHCO3 D.Na2SO4
第Ⅱ卷(共84分)
|
21.用下图装置进行实验,下表中实验结果能说明结论的是 ( )
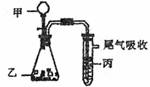
|
|
甲 |
乙 |
丙 |
结论 |
|
A |
水 |
电石 |
溴水 |
稳定性:水>C2H2>Br |
|
B |
盐酸 |
石灰石 |
苯酚钠溶液 |
酸性:HCl>H2CO3>苯酸 |
|
C |
盐酸 |
FeS |
溴水 |
还原性:S2->Br->Cl- |
|
D |
浓盐酸 |
KMnO4 |
KBr溶液 |
氧化性:KMnO4>Cl2>Br2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com