
4.某品牌消毒液的商品标识上注明:①本品为无色液体,呈碱性;②使用时应加水稀释;③可对餐具进行消毒,并能漂白浅色衣物。据此判断其有效成分可能是 ( )
A.HClO B.Na2SO3 C.H2O2 D.NaClO
3.将0.1mol下列物质置于1L水中充分搅拌,溶液中阴离子数目最多的是 ( )
A.KCl B.Mg(OH)2 C.Na2CO3 D.MgSO4
2.化学反应前后肯定没有变化的是 ( )
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
A.①④ B.①③⑤ C.①③④ D.①②③④
1.硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。下列物品的制造用到硅单质的是 ( )
A.玻璃制品 B.石英钟表 C.计算机蕊片 D.光导纤维
26.(8分)已知合成氨的反应: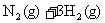

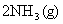 ,在某温度下达到平衡时,各物质的物质的量浓度是
,在某温度下达到平衡时,各物质的物质的量浓度是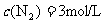 ,
,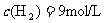 ,
,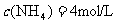 ,求:
,求:
(1)该温度时的平衡常数;
(2)求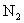 和
和 的起始浓度;
的起始浓度;
(3)在该温度下,若起始时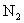 的物质的量浓度是5
的物质的量浓度是5 ,
, 的物质的量浓度是16
的物质的量浓度是16 ,当
,当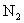 的转化率为20%时,反应是否达到平衡状态?若未达到平衡状态,反应向哪个方向进行?
的转化率为20%时,反应是否达到平衡状态?若未达到平衡状态,反应向哪个方向进行?
25.(6分)设水的电离平衡曲线如图所示:
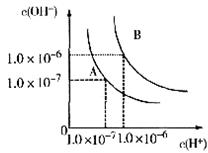
(1)若以A点表示室温下水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态移至B点,则此时水的离子积从 增加到 。
(2)将pH=8的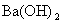 溶液与pH=5的稀盐酸相混合,并保持100℃的恒温,欲使混合溶液的pH=7,则
溶液与pH=5的稀盐酸相混合,并保持100℃的恒温,欲使混合溶液的pH=7,则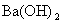 与盐酸的体积比为
。
与盐酸的体积比为
。
24.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL的容量瓶中定容成250mL烧碱溶液;
B.用移液管移取10.00mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为M mol/L的标准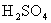 溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL;
溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点时刻度数为V2mL。
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写) → → → → 。
(2)操作E中在锥形瓶下垫一张白纸的作用是 。
(3)操作D中液面应调整到 ,尖嘴部分应 。
(4)滴定终点时锥形瓶内溶液的pH约为 ,终点时颜色变化是 。
(5)若酸式滴定管没有用标准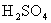 润洗,会对测定结果有何影响
(填偏高、偏低或无影响,其他操作均正确)。
润洗,会对测定结果有何影响
(填偏高、偏低或无影响,其他操作均正确)。
(6)该烧碱样品的纯度计算式为 。
23.(10分)在一定温度下,将2mol A和2molB两种气体相混合予容积为2L的某密闭容器中,发生如下反应: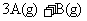

 ,2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:
,2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于 ;
(2)A的转化率为 ;
(3)生成D的反应速率为 ;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 (填增大、减小或不变);
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各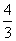 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入
物质
mol。
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入
物质
mol。
22.(10分)在一定温度下,容积为1L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,请回答下列问题。
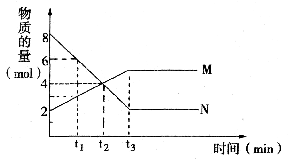
(1)该反应的化学方程式为:
(2)t1时生成M反应速率 (填大于、小于或等于)生成N反应速率。
(3)达到平衡状态的时间为 ,此时N的转化率为 。
(4)若生成M反应为吸热反应,在压强不变的情况下升高温度、容器的体积将 (填增大、减小或不变)。
21.(6分)火箭推进器中盛有强还原剂液态肼(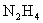 )和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出256.65kJ的热量。
)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出256.65kJ的热量。
(1)该反应的热化学方程式为 ,
(2)又已知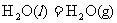
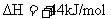 ,则l6g液态肼与液态双氧水反应生成液态水时放出的热量是
kJ。
,则l6g液态肼与液态双氧水反应生成液态水时放出的热量是
kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com