
15.常温下,有甲、乙两份体积为1L、浓度均为0.1 mol·L-1的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2 mol·L-1的盐酸混合,在混合溶液中:n(NH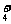 )+n(H+)-n(OH-)=bmol。a、b正确的答案组合是( )
)+n(H+)-n(OH-)=bmol。a、b正确的答案组合是( )
A.9<a<11;0.1 B.9<a<11;0.2 C.12<a<13;0.2 D.13;0.1
14.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如右下表。据此判断下列结论正确的是 ( )
|
B.A的转化率比B的转化率低
C.在容器中发生的反应为:
 2A+B 2C
2A+B 2C
D.在t2~t3内A的平均反应速率为:
[1/(t3-t2)]mol·L-1·s-1
13.下列各组物质,前者加入后者时,无论前者是否过量,都能用同一离子方程式表示的是
( )
A.稀盐酸,Na2CO3溶液 B.氯化铝溶液,氨水
C.碳酸氢钠溶液,澄清石灰水 D.溴化亚铁溶液,氯水
12.已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是 ( )
A.NaOH溶液 B.氨水 C.KMnO4、ZnCO3 D.H2O2、ZnO
11.某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22(mol·L-1)2,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为 ( )
A.13 B.12 C.11 D.10
9.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
( )
A.Na+ H+ Cl- NO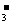 B.K+ Ba2+ OH- I-
B.K+ Ba2+ OH- I-
C.Na+ Mg2+ Cl- SO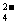 D.Cu2+ S2- Br- ClO-
D.Cu2+ S2- Br- ClO-
|
A.四种元素位于同一周期 B.氢化物的稳定性H2Y>HZ
C.离子的氧化性aW3+>bX+ D.a+3=c-2
8.物质的提纯是化学实验中的一项主要操作,也是化工生产及物质制备中的主要环节。下列有关叙述中,不正确的是 ( )
A.乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开
B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后将所得沉淀滤出,即得较纯的蛋白质
C.油脂的提纯中,可将油脂加入NaOH浓溶液中加热,然后过滤,滤出的溶液即为较纯的油脂
D.甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应先加入适量的活性炭,经搅拌、过滤、蒸发结晶,即得较纯的蔗糖
7.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中正确的是 ( )
A.由Fe跟Cl2直接化合可得FeCl3,类推出Fe跟I2直接化合可得FeI3
B.金属镁失火不能用CO2灭火,类推出金属钠失火也不能用CO2灭火
C.CO2与Na2O2反应生成Na2CO3和O2,类推出SO2与Na2O2反应生成Na2SO3和O2
D.相同温度下,CaCO3的溶解度比Ca(HCO3)2的溶解度小,类推出Na2CO3的溶解度也小于NaHCO3的溶解度
6.判断下列化学基本概念的依据不正确的是 ( )
A.溶液的酸碱性:溶液中c(H+)和c(OH-)的相对大小
B.强弱电解质:溶液的导电能力大小
C.离子化合物:化合物中是否含离子键
D.氧化还原反应:元素化合价是否变化
5.下列观点错误的是 ( )
A.宏观物质都是由微观粒子构成的,微观粒子的种类和数量不同、彼此的结合方式多样化决定了物质的多样性
B.分子是保持物质化学性质的一种微粒,如果分子的组成或结构变了,其化学性质就变了
C.构成宏观物质的微观粒子之间存在多种形式的相互作用,如离子键、共价键等
D.储存在物质中的化学能在化学反应前后是不变的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com