
13.高铁电池是一种新型的可充电电池,其电池的总反应为3Zn+2K2FeO4+8H2 3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是 ( )
A.放电时负极反应为:3Zn-6e-+6OH-=3Zn(OH)2
B.充电时阳极反应为:2Fe(OH)3+10OH--6e=2FeO42-+8H2O
C.放电时正极附近溶液的碱性增强
D.放电时每转移3mol电子,正极有1molK2FeO4被氧化
第Ⅱ卷
12.向某密闭容器中充入1molCD和2molH2O(g),发生反应:CO+H2O(g) CO2+H2。
CO2+H2。
当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x 是 ( )
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
11.已知可逆反应mA(g)+nB(g) pC(g);△H<0,当其他条件不变时,C的体积分数a随时间的变化如图所示,有关该反应的说法中正确的是 ( )
pC(g);△H<0,当其他条件不变时,C的体积分数a随时间的变化如图所示,有关该反应的说法中正确的是 ( )
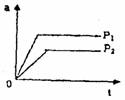
A.m+n<p
B.达平衡后,升高温度,A的转化率增大
C.达平衡后,降低温度、增大压强有利于生成C
D.达平衡后,缩小容器体积,混合气体的平均摩尔质量减小
9.足量铜与一定量浓硝酸反应得到硝酸铜溶液的NO2、N2O4、NO是混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LnaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.60mL B.45mL C.30mL D.15mL
|
A.10mol B.11mol C.12mol D.13mol
8.有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,物质的量浓均为0.1mol·L-1,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
7.由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是 ( )
①K+、Cl-,NO3- 、S2- ②K+、Fe2+、I-、SO42 -
③Na+、Cl-、NO3- 、SO42 - ④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、Cl-、NO3-
A.①③ B.②⑤ C.③④ D.③⑤
6.能正确表示下列反应的离子方程式是 ( )
A.醋酸钠的水解反应 CH3COO-+H3O+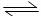 CH3COOH+
H2O
CH3COOH+
H2O
B.碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+ 2H2O+ CO32-
C.苯酚钠溶液与二氧化碳反应 C6H5O-+ CO2+ H2O=C6H5OH+CO32-
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
33.(8分)[化学--有机化学基础]
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位--“奖赏中心”给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并因为在各区域之间传递信息的物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。已知多巴胺的结构式为:
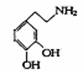
请回答下列问题:
(1)多巴胺的分子式为 。
(2)多巴胺可能发生的化学反应为 (填字母)
A.加成反应 B.取代反应 C.氧化反应 D.水解反应
(3)多巴胺可由香兰素与硝基甲烷反应后再经锌汞齐还原水解制得。合成过程可表示如下:
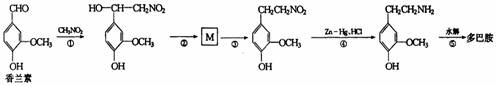
I.反应①属于 反应(填反应类型)
II.写出M的结构简式 。
III.多巴胺分子中羟基处于苯环上不同位置时的同分异构体共有 种(苯环上的其他结构不变)。
IV.写出反应⑤的化学方程式 。
32.(8分)[化学--物质结构与性质]
下表是元素周期的一部分,其中所列字母分别代表某一元素。
|
a |
|
|
|
b |
|||||||||||||
|
|
e |
|
|
|
|
|
c |
d |
|
|
|||||||
|
|
|
|
f |
|
g |
h |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
请根据表中所列元素,回答下列问题:
(1)基态原子的价电子层中,未成对电子数最多的元素是 (填写表中字母);写出其价电子的轨道表示式 ;当此元素的原子与a元素的原子形成简单的分子时,该元素的原子以sp3形式杂化,所形成简单分子的立体构型为 ,该分子为 分子(填“极性”或“非极性”)。
(2)写出j元素基态原子的电子排布式 ;d、g、j分别与a形成化合物,推断所形成的化合物沸点由高到低的排列顺序为 (填化学式)。
(3)可用来组成酸、碱、盐三类物质至少需要的元素有 (填写表中字母);e、f单质及ef合金中硬度由大到小的顺序为 (填写名称)
31.(8分)[化学--化学与技术]
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
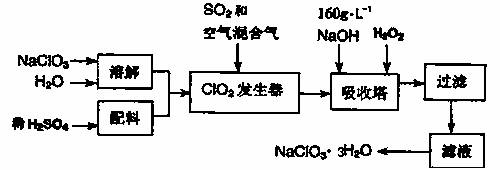
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解。
③HClO2在25℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸。
(1)160g·L-1NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个数据是 。
(2)ClO2发生器中发生反应的化学方程式为 。
(3)吸收塔中为防止产物NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 (选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体还必须进行的操作是 (选操作名称)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com