
27.(10分)根据下列框图填写下列空格:
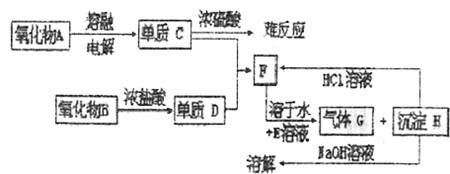
(1)写出下列物质的化学式:A ,C ,D ,F 。
(2)写出下列反应的离子方程式:
B与浓盐酸: 。
H与NaOH溶液: 。
(3)在常温下,单质C与浓硫酸共存的现象为: 。
26.(10分)与纯水的电离相似,在液氨中也存在关微弱的电离:2NH3 NH+4+NH-2
NH+4+NH-2
(1)据此判断以下叙述中错误的是 。
A.液氨中含有NH3、NH+4、NH-2等微粒
B.一定温度下液氨中C(NH+4)·C(NH-2)是一个常数
C.液氨的电离达到平衡时C(NH3) =C(NH+4)=C(NH-2)
D.只要不加入其他物质,液氨中C(NH+4)=C(NH-2)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体 。
②列举在液氨中,与“H++OH-=H2O”的实质相类似的化学方程式
。
(3)NaNH2加入水中,是否有化学反应发生 ,写出可能的化学反应方程式
。
25.(7分)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇
(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
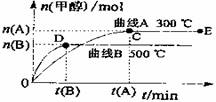
根据题意完成下列各题:
(1)反应达到平衡时,如果升高温度,CH3OH的体积分数 (填“增大”、“减少”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因可能是: (用化学方程表示)。
24.(7分)
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:
H2O2+2Fe3+ === 2Fe2++O2↑+2H+, H2O2+2Fe2++2H+ === 2Fe2++2H2O
在以上反应中Fe3+实际起着 作用,总反应式为 。
(2)I2与Fe3+一样也可以发生上述类似反应,类比(I)在下面填入合适的化学反应方程式:H2O2+I2 == 2HIO, 。总反应为 。
(3)在硫酸和KI混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为 。
(4)铁酸钠(Na2 FeO4)可作为一种新型净水剂,在反应中Na2 FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净化水,除了具有强氧化性,能消毒杀菌外,另一原因是 。
23.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A
=== H+HA-
HA-
 H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显 (填“酸性”,“中性”,若“碱性”)。
理由是 (用离子方程式表示)。
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 B.c(OH-)=c(H+)+c(HA-)
C.c(H+)=c(OH-)+c(HA-)+2c(A2-) D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能是 0.11mol·L-1(填“<”,“>”,或“=”),理由是: 。
22.有CuO和Fe2O3的混合物ag,加入2mol/L的HCl溶液50mL,恰好完全溶解,若将2ag该混合物在CO气流中加热并充分反应,冷却后,剩余固体的质量为 ( )
A.(2a-3.2)g B.(2a-1.6)g C.1.6ag D.0.8ag
第Ⅱ卷(共84分)
|
21.在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1gN2和1gH2,乙容器中充入2gN2和2gH2。下列叙述中,错误的是 ( )
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
20.设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.0.1mol Na与O2反应,生成Na2O和Na2O2混合物时,失去电子的数目为0.1NA
B.0.1molFe在O2中燃烧生成FeO和Fe2O3时失去电子的数目为0.2NA
C.0.1mol/L Na2CO3溶液中含CO2-3数目为0.1NA
D.2.7gAl与足量的稀NaOH溶液反应可生成AlO-2数目为0.1NA
19.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH  CH3COO-+H+,要使溶液中c(H+) / c(CH3COOH)值增大,可以采取的措施是 ( )
CH3COO-+H+,要使溶液中c(H+) / c(CH3COOH)值增大,可以采取的措施是 ( )
A.加少量烧碱溶液 B.减低温度 C.加水 D.加少量冰醋酸
18.在室温下,体积相等的CH3COOH溶液与NaOH溶液反应,若反应后溶液呈酸性,则下列对两种溶液的判断正确的是 ( )
A.CH3COOH溶液与NaOH溶液的物质的量浓度相等
B.NaOH与CH3COOH的质量相等
C.两溶液的pH之和小于14
D.以上情况都不可能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com