
11.类推的思维方法在化学学习与研究中常会产生错误的结论。因此,类推出的结论最终要经过实践的检验才能决定其正确与否。以下几种类推结论中,正确的是 ( )
A.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可以写成PbO·Pb2O3
B.不能用电解AICl3溶液来制取金属铝,也不能用电解MgCl2溶液来制取金属镁
C.Fe和S直接化合不能得到Fe2S3,AI和S直接化合也不能得到Al2S2
D.FeS可以和稀硫酸反应制取硫化氢气体,CuS也可以和稀硫酸反应制取硫化氢气体
10.在给定的四种溶液中,各离子能大量共存的是 ( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH+4、Cl-、I-
B.所含溶质为NaNO3的溶液:K+、HSO-4、Cl-、S2O2-3
C.含有大量H+的无色溶液:Na+、Fe3+、NO-3、MnO-4
D.能使pH试纸变为蓝色的溶液:Na+、Cl-、S2-、SO2-3
9.室温下,下列混合溶液中,各离子浓度的关系正确的是 ( )
A.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
c(NH+4)>c(Cl-)>c(OH-)>c(H+)
B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合
c(Na+)>c(SO2-4)>c(NH+4)>c(H+)>c(OH-)
C.浓度均为0.1mol·L-1的小苏打溶液与氢氧化钠溶液等体积混合
c(Na+)+c(H+)=2c(CO2-3)+c(OH-)
D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化溶液等体积混合
|
8.下列对化学平衡移动的分析中,不正确的是 ( )
①已达平衡的反应C(s)+H2O(g)  CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定发生移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
7.设NA为阿佛加德罗常数,下列说法正确的是 ( )
A.20克D2O中含有的质子数为12NA
B.1molCH3+中含电子数为10NA
C.500mL 0.5mol/L的Ca(NO3)2的溶液中,含有的NO-3的数目为0.5NA
D.常温常压下11.2LCO2气体通过足量的Na2O2充分反应,转移电子数为2NA
6.某校学样用化学知识解决生活中的问题,下列家庭小实验不合理的是 ( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
31.(10分)铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
请回答下列问题:
(1)向原混合物中,逐滴加入过量硝酸,充分反应,下列说法正确的是 。
a. 铁粉先反应,生成Fe2+ b. 铁粉全部溶解后,铜粉才反应
c. 最后溶液中含Fe3+和Cu2+
(2)在实验中,所用硝酸的浓度为 。
(3)在实验①中,溶解了Fe的质量是否为5.6g: ;实验②中溶解了Cu是否为9.6g: (填“是”或“否”)。
(4)在实验④中,V的值为: 。
30.(6分)有50mL NaOH溶液,向其中逐渐通入一定量的CO2,取此溶液10mL将其
稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的HCl溶液,产生CO2
气体的体积(标准状况)与所加入盐酸体积之间的关系如图所示:
回答下列问题:
(1)稀释后的溶液中含有的溶质为 。
(2)标准状况下生成CO2的体积为 。
(3)原NaOH溶液的物质的量浓度为 。
29.(14分)氮化铝(AN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含碳或氧化铝杂质,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应ALN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实际现象来确定杂质的成分(实验中导管体积忽略不计)。
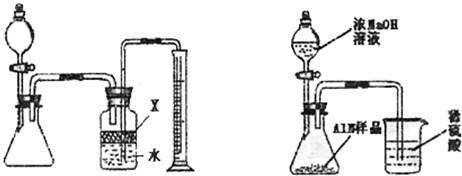
(1)实验有关操作为:a、往锥形瓶中放入适量的AlN样品;b、从分液漏斗往锥形瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积。
正确的操作顺序为 。
(2)本实验中检验装置气密性的方法是 。
(3)广口瓶中的试剂X可选用的是 (填选项的标号)。
A.汽油 B.酒精 C.植物油 D.CCl4
(4)若广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将 (填“偏大”“偏小”或“不变”)。
(5)实验结束后,若观察到锥形瓶中还有固体,则样品含有的杂质是 。
(6)已知样品的质量为Wg,若实验结束后测得氨气的体积为aL(标况下),则样品中AlN的质量分数为 (AlN的式量为41)。
(7)有人改用图II装置进行同样的实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为是否可行? (填入“可行”、“不可行”)。原因是 。
28.(10分)下图中所示的实验方法、装置或操作有明显错误,指出错误所在,不必作图。
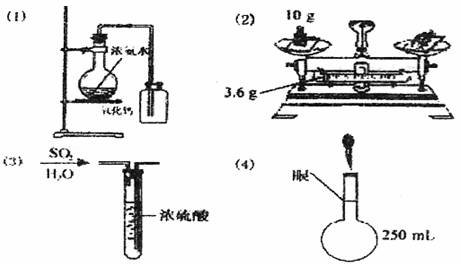
(1)制取氨气:错在 。
(2)称量硝酸钾固体:错在 ,这种称量方法,实际所得硝酸钾的质量是 。
(3)干燥SO2体:错在 。
(4)将溶液稀释至250mL定容时,观察点如图所示,错在 ,此时所配制的溶液浓度偏 (填“大”或“小”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com