
9.下列说法正确的是(NA为阿伏加德罗常数)
A.在1mol甲基(-CH3)中,电子总数9NA个电子
B.在1mol的Na2O2中,有2NA个阴离子
C.标准状况下,22.4L CH3C1和CHC13的混合物所含有的分子数目为NA
D.Mg、A1为电极,NaOH溶液为电解质溶液所构成的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L
|
A.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸
B.将裂解气通入到酸性KMnO4溶液中来证明裂解气中一定有乙烯
C.用灼烧的方法可将纯棉织品、毛织品和腈纶织品三种物质鉴别开来
D.用新制的Cu(OH)2并加热可检验尿液中的葡萄糖
11.下列离子方程式书写不正确的是 ( )
A.在硫酸氢钠溶液中加入等物质的量的氢氧化钡溶液
H++SO42-+Ba2++OH- BaSO4↓+H2O
B.在碳酸氢钠溶液中加入等物质的量的氢氧化钡溶液:
HCO3-+OH-+Ba2+ BaCO3↓+H2O
C.在氯化铝溶液中加入过量氨水:
A13++3NH3·H2O A1(OH)3↓+3NH4+
D.向纯碱溶液中加入醋酸溶液:
Ca32-+2H+ CO2↑+H2O
12.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关此电池的推断正确的是 ( )
A.负极反应为:14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围的pH升高
C.理论上消耗1mol C2H6,电路上转移的电子为14mol
D.放电过程中,K+向负极移动
13.元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”。据此判断下列叙述中不正确的是 ( )
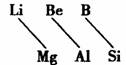
A.Li在N2中燃烧生成Li3N
B.Li在空气中燃烧生成Li2O3
C.Be(OH)2既能溶于强酸又能溶于强碱溶液
D.硼酸钠溶液显碱性
14.下列依据热化学方程式得出的结论正确的是 ( )
A.已知C(石墨,s)=C(金刚石,s)△H>0则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g)△H1
C(s)+1/2O2(g)=CO(g)△H2则△H1>△H2
C.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H=-57.3kJ/mol则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
15.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
B.在0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
C.pH>7的NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-)>c(OH-)>c(H+)
D.pH>7的CH3COONa与NaOH的混合溶液中一定有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
第Ⅱ卷(必做部分120分+选做32分,共152分)
[必做部分]
28.(15分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常下都是气体,在适当的条件下它们两两化合可以分别生成化合物A、B、
C,其转化关系如图:
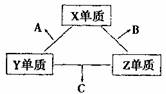
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。
请回答下列问题:
(1)位于第四周期与X元素同族的元素M,原子核外的电子数为 ;该元素最高价氧化物的水化物的化学式为 ;
(2)C在一定条件上,能与X单质反应生成两种化合物A和B,写出该反应的化学方程式: ;
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐,该盐水溶液的pH 7(填“大于”、“小于”、“等于”),其原因是(用离子方程式表示): ;
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
①达到化学平衡时,正反应速率与逆反应速率相等
②反应过程中,Y单质的体积分数始终为50%
③达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
④达到化学平衡的过程中气体平均相对分子质量增大
⑤达到化学平衡后,升高温度,C的体积分数增大
(5)X与Y形成的化合物中,X原子所含的质子总数与Y原子所含的质子总数之比为16:7,其化合物的分子式为 。
29.(10分)某实验小组欲制取氧化铜,并证明氧化铜能加快氯酸钾的分解,进行如下实验:
29.云南部分州市大面积种植甘蔗,为充分利用蔗糖生产中的甘蔗渣,现研发以甘蔗渣(主要成分是纤维素)为原料制备合成纤维及甘油酸等化工产品,工艺流程如下:
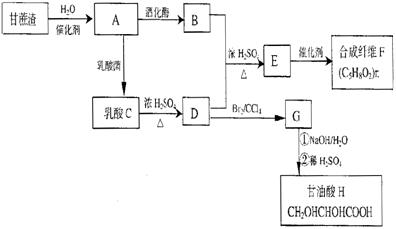
已知:A既是甘蔗渣也是淀粉水解的最终产物,C分子中含有一个甲基,A、C具有相同的最简式,且M(A)=2M(C)。
回答下列问题:
(1)写出下列物质的结构简式:B 、F ;
(2)写出下列反应的化学反映方程式并指出反应类型
 D:
,反映类型
;
D:
,反映类型
;
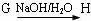 的钠盐:
反映类型
;
的钠盐:
反映类型
;
(3)任意写出C的两种同分异构体的结构简式 、 ;
(4)经测定45gA固体完全氧化生成液态水时能放出701kJ的热量,写出该反应的热化学方程式 。
28.(16分)水溶性无机富锌涂料对防止钢铁腐蚀具有重要作用,研究表明无机富锌涂料中掺入少量铝粉可延长钢铁的抗腐蚀年限。请回答下列问题。
(1)铝元素在周期表中处于 (填周期数、主族数);Al3+的结构示意图为 。
(2)无机富锌涂料在防止钢铁腐蚀的过程中,锌电极上的电极反应为 ,
掺入少量铝粉的无机富锌涂料能使钢铁抗腐蚀能力增强的可能原因之一是
。
(3)铝热反应在冶炼金属及定向爆破等实际应用中有着重要的用途。铝和氧化铁在高温条件下反应,当转移3mol电子时,产生铁的质量是 g。
(4)铝铵矾[NH4A(SO4)2·12H2O]是一种重要的复盐,当向铝铵矾稀溶液中逐滴加入0.1mol·L-1 NaOH溶液出现了如下a、b、c三个阶段的图象
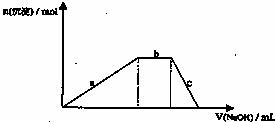
根据上图完成下列离子反应方程式:
b阶段: ;
c阶段: 。
27.(14分)A、X、Y、Z是中学常见的单质和化合物。它们在一定条件下能发生如下转化,转化中的部分产物已省略
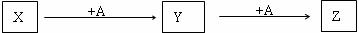
(1)若A为氧化性的单质,Z为淡黄色固体。则Z中阴阳离子个数的最简比是 ;
如果将Z投入到含有少量酚酞的水溶液中可能出现象是
。
(2)若X为黑色非金属单质,A既是氧化物又是氢化物。写出X在一定条件下转化为Y的化学反应方程式: ;A与同族其他氢化物相比,其沸点差异较大的原因是 。
(3)若X是由主族元素和过度元素形成的化合物(俗名:黄铁矿)。且上述转化是无机化工中生产某种酸的重要反应。则:
X→Y的化学反应方程式为 ;
Y→Z的工业设备名称是 。
26.(14分)
(I)某同学拟用下图装置分别制取H2和NO。而实验室只有水、浓硫酸、浓硝酸、铜片。

①制取H2时,还缺少的固体试剂是 ,(填名称)反应的离子方程式: ;
②制取NO时,请你从上述试剂中为他选择比较合理的试剂是 ;反应产生的气体需要用 法收集。
(Ⅱ)有一份两种物质混合而成的白色混合物,分别取适量该混合物置于三支试管中进行实验。
①加热第一支试管中的白色混合物,使管口有水滴凝结
②在第二支试管中逐滴加入4mol·L1的NaOH溶液至过量,同时不断震荡试管,有气泡产生,反应结束后试管中还有白色不溶物
③在第二支试管中逐滴加入4mol·L1盐酸,同时不断震荡试管,有无色无味的气体产生,反映结束后得到的无色透明溶液
(1)符合以上实验现象的是 混合物(填选项);
A.NaHCO3、AgO3 B.BaCl2、MgCO3
C.NH4HSO3、MgCl2·6H2O D.NH4Cl、Ca(HCO3)2
(2)该混合物中的某一物质水溶液的pH<7,该物质是: (填化学式);
(3)该混合物在实验②中产生白色不溶物的离子方程式:
。
13.某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为 ( )
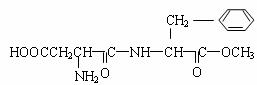
下列有关A的叙述中正确的是
A.A的分子式为:C14H13O5N2
B.A可以发生水解反应、中和反应、加成反应、消去反应
C.A物质完全水解的产物中,一定含有醇类
D.在一定条件下,1molA最多能与1L2mol·L-1NaOH溶液反应
第Ⅰ卷(非选择题 共174分)
|
12.对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是 ( )
A.化学反映速率变化时,化学平衡一定发生移动
B.只有在催化剂存在下,才会发生化学反应速率变化而化学平衡不移动的情况
C.可逆反应进行得越彻底,化学反应速率就越大
D.化学平衡发生移动时,化学反应速率一定变化
11.下列说法中正确的是 ( )
A.冰醋酸溶于水时,分子中羚基上的氢氧共价键部分发生断裂
B.原子及其离子的核外电子层数等于该元素所在的周期数
C.同一元素的各种同位素的物理性质、化学性质均相同
D.氯化钠熔化时离子键未被破坏
9.NA为阿伏加德罗常数,下列说法中不正确的是 ( )
A.7gCnH2n中含有的氢原子数目为NA
B.1mol溶态中CHCl3中原子总数等于NA
C.1mol C5H12分子中所含单键数为16NA
D.常温常压下,1mol D216O中含中子数、质子数、电子数均为10NA
|
A.钠跟水的反应:2Na+2H+====2Na+ +H2↑
B.电解饱和食盐水 2Cl- +2H2O H2↑+Cl2+2OH-
H2↑+Cl2+2OH-
C.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+===BaSO4↓
D.酸性硫酸亚铁溶液中加入过氧化氢溶液 Fe2+ +2H++H2O2===Fe3++2H2O
8.已知下列元素的原子半径为
|
原子种类 |
N |
S |
O |
Si |
|
原子半径(nm) |
0.075 |
0.102 |
0.074 |
0.117 |
根据以上书库。磷原子的半径可能是 ( )
A.0.100 nm B.0.110 nm C.0.080 nm D.0.070 nm
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com