
8.25℃时,某一元强碱溶液的pH为a,某一元酸HA溶液的pH为b,电离度为1.0%。若将1体积的此强碱溶液与10体积的HA溶液混合,恰好完全反应。则a与b之和为( )
A.14 B.15 C.16 D.17
7.反应H2(g)+I2(g)  2HI(g)的平衡常数为K1;反应HI(g)
2HI(g)的平衡常数为K1;反应HI(g)  1/ 2H2(g)+
1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值) ( )
1/ 2H2(g)+
1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值) ( )
A.K1= 2K2 B.K1= K22 C.K1 =1/K22 D.K1= 1/2K2
6.醋酸钡晶体[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关0.1mol·L-1醋酸钡溶液中粒子浓度的比较中错误的是 ( )
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
5.下列离子方程式书写正确的是 ( )
A.向硅酸钠溶液中通入过量的二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32-
B.向氯化铝溶液中加入过量的氨水:Al3+ +4NH3·H2O=AlO2-+4NH4++2H2O
C.向澄清石灰水中滴加过量碳酸氢钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.向硝酸亚铁溶液中加入稀盐酸:Fe2++4H++NO3- == Fe3++NO↑+2H2O
4.下列反应过程中,ΔH>0且ΔS>0的是( )
A.NH3(g)+HCl(g)===NH4Cl(s)
B.CaCO3(s) CaO(s)+CO2(g)↑
CaO(s)+CO2(g)↑
C.4Al(s)+3O2(g) 2Al2O3(s)
2Al2O3(s)
D.HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l)
3.用下列实验装置完成对应的实验,能达到实验目的的是 ( )
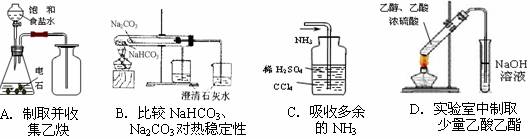
2.奥运会火炬可用丙烷或丁烷作燃料。已知丙烷的沸点为-42.1℃,燃烧热为2219.2kJ/mol;正丁烷的沸点为-0.5℃,燃烧热为2877.6kJ/mol。下列判断中错误的是 ( )
A.奥运火炬中燃料燃烧主要是将化学能转变为热能和光能
B.烷烃沸点和燃烧热都随碳原子数增加而成比例递增
C.异丁烷的沸点肯定低于-0.5℃
D.正己烷在常温常压下肯定不是气体
1.2007年诺贝尔化学奖获得者格格德•埃特尔在表面化学研究领域作出了开拓性贡献。研究气体在固体表面反应的化学已经成为化学科学的一个重要分支,它涉及生产生活中的许多重要领域。下列不属于气体与固体作用的表面化学研究领域的是 ( )
A.合成氨工业是将氮气和氢气在铁催化剂的表面转化成氨气
B.汽车中装有的催化器,能将尾气中一氧化碳和氮氧化物转化为二氧化碳和氮气
C.在燃料电池中,氢气和氧化剂在催化剂表面反应所产生的能量转化为电能
D.加酶洗衣粉的乳化作用能将衣物纤维表面的油渍洗去。
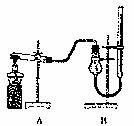
(二)证明氧化铜能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较用下图装置进行实验,实验时均以生成25mL气体为准,其可能影响实验的因素均已忽略。相关数据见下表:
|
实验序号 |
KC1O3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2g |
无其他物质 |
|
|
⑤ |
1.2g |
CuO 0.5g |
|
|
⑥ |
1.2g |
MnO2 0.5g |
|
回答下列问题:
(3)上述实验中的“待测数据”指 ;
(4)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,然后
。
(5)为探究CuO在实验⑤中是否起催化作用,需要做以下实验(无需写出具体操作):
a. ,b检验CuO的化学性质是否改变。
30.(17分)I:碳酸钠俗称纯碱,是一种常用的化学品,工业上制取碳酸钠的方法是:将二氧化碳和氨气通入饱和食盐水中,控制一定温度,制得碳酸氢钠,再加热碳酸氢钠,即可得碳酸钠,有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaC1=NaHCO3↓+NH4C1
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 。
A.碳酸氢钠难溶于水
B.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
C.碳酸氢钠受热易分解
(2)有一位同学按如下操作进行了实验:饱和食盐水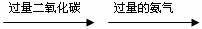 ,结果始终没有产生沉淀,你认为原因是
。
,结果始终没有产生沉淀,你认为原因是
。
Ⅱ:按以上方案制取的纯碱中是NaC1、Na2CO3·10H2O和NaHCO3的混合物,某同学设计实验,通过测量的反应前后C、D装置质量变化,测定该混合中各组分的质量分数。
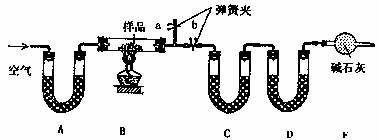
(1)装置A、C中的试剂分别是A ,C 。
(2)加热前通入空气的目的是 ,操作方法是 。
(3)若样品质量为Wg,反应后C、D增加的质量分别是m1g、m2g,试计算混合物中Na2CO3·10H2O的质量分数为 (用含W、m1、m2,的代数式表示)。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
31.(8分)[化学--化学与技术]
工业“从海水中提取镁”的流程图如下:
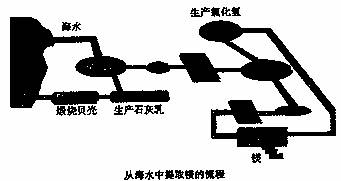
其步骤为:
①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgC12溶液,再经蒸发结晶得到MgC12·5H2O;
④将MgC12·6H2O在一定条件下加热得到无水MgC12;
⑤电解熔融的氯化镁可得到Mg。
请回答下列问题:
(1)步骤③中的蒸发量是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、铁架台等。
(2)步骤④中的“一定条件”指的是 ,目的是 。
(3)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写了出其中一点: 。
(4)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是 。
理由中
。
32.(8分)[化学--物质结构与性质]
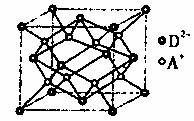
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后, 3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1。
请回答下列问题:
(1)A元素形成的晶体属于密置堆积方式,则其晶体晶胞类型属于 。(填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布方式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”,“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,设晶胞的边长为acm。则R晶体的密度为 。(阿伏加德数常数用NA表示)
33.(8分)[化学--有机化学基础]
目前用于抗幽门螺旋杆菌的常见高效抗生素是氨苄青霉素,它可由青霉素来合成。
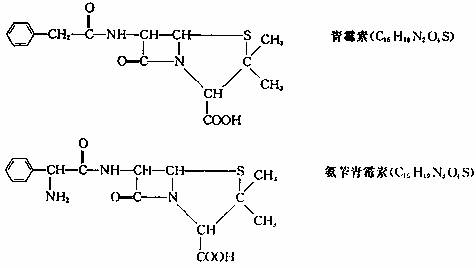
已知:
下图是青霉素制取氨苄青霉素的合成路线:
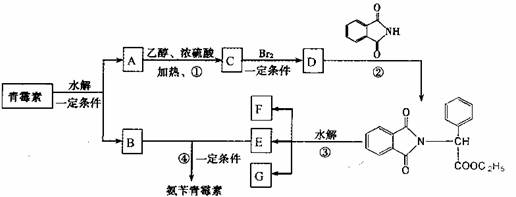
请回答下列问题:
(1)写出反应①②的反应类型:
① ,② 。
(2)写出D的结构简式 。
(3)写出反应①③的化学方程式:
① ,
③ 。
(一)制取氧化铜
①称取2gCuSO4·5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀;然后将所得混合物转移到蒸发皿中,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤、晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是 (填实验步骤序号)。
(2)步骤①、③中研磨固体所用仪器的名称是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com