
7.设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,11.2L的甲烷气体中含甲烷分子数为0.5NA
B.0.5L 1mol·L-1的NH4CL溶液中含NH4+数为0.5NA
C.2.8g铁粉与硝酸反应失去的电子数一定为0.15NA
D.14g乙烯和丙稀的混合物中原子总数为3NA
6.下列各组物质比较中,不正确的是 ( )
A.单质的熔点:Li>Na>k, Na<Mg<Al
B.氢化合物的沸点:H2O>H2S, HF>HBr
C.分子的稳定性:HF<H2O<NH3, O2>N2
D.离子半径:N3->Na+>Mg2+, S2->O2-
5.过氧化氢俗称双氧水,为一种易分解无色液体,常作氧化剂、漂白剂和消毒剂。为贮存、运输、使用方便,工业上将H2O2转化为固体的过碳酸钠(化学蚀为:2Na2CO3·3H2O2),
该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使通过碳酸晶体失效变质的是
( )
A.K2S B.NaHCO3 C.稀HCl D.MnO2
4.下列说法中正确的是 ( )
①电解是将电能转化为化学能;②电解是将化学能转变成电能;③电解质溶液导电是化学变化,金属导电是物理变化;④不能自发进行的氧化还原反应可通过电解的原理实现;⑤任何物质被电解时,必导致氧化还原反应发生;
A.①③④⑤ B.②③⑤ C.③④ D.①②③④
3.下列各组物质中,前一种与后二种物质反应后不能产生同一种气体的是 ( )
A.Al、NaOH溶液、盐酸 B.(NH4)2S、NaOH溶液、盐酸
C.H2O、Na2O2、F2 D.NaHCO3、NaHSO4溶液、盐酸
2.下列说法正确的是 ( )
A.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
B.液氨、石墨和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.纯碱、硝酸、硬脂酸钠和干冰分别属于碱、酸、盐和氧化物
1.2007年9月,美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,这很可能是21世纪人类最伟大的发现之一,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是 ( )
A.分子间作用力 B.氢键 B.非极性共价键 D.极性共价键
2l A.《物质结构与性质》(12分)
(1)前三周期元素中第一电离能最小的是 (填元素符号),其基态原子的电子排布式为 。第二周期非金属元素形成的氢化物中化学键极性最大的是
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
(3)晶格能的大小:MgO NaCl,键能的大小:HBr HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
|
代号
|
|
结构式
|
水中溶液解度/g(25℃)
|
熔点/℃ |
沸点/℃
|
||
|
A
|
邻-硝基苯酚
|
|
0.2
|
45
|
100
|
||
|
B
|
对-硝基苯酚 |
|
1.7
|
114
|
295
|
21 B。《实验化学》(12分)七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
|
温度 / ℃ |
10 |
30 |
40 |
50 |
60 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
|
MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
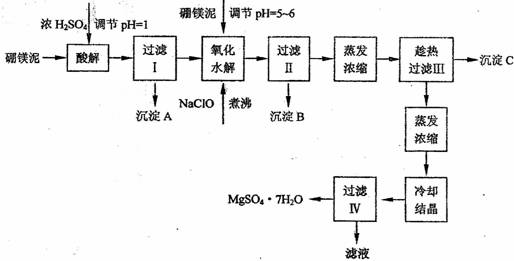
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的是_ 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤II需趁热过滤的理由是
20.(9分)某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL 5 moL HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是 。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是 mL,沉淀的最大质量是 g(用含a的代数式表示)
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数(写出计算过程)。
19.(11分)维生素C(分子式为C6H8O6)可预防感染、坏血病等。其工业合成路线如下图所示:
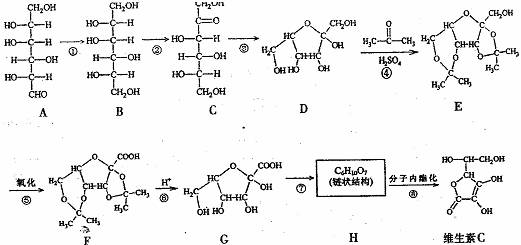
I.(1)上述①-③反应中,属于加成反应的有 (填数字序号)。
(2)A-G七种物质中与C互为同分异构体的有 (填字母序号)。
(3)比较D和G的结构可知,G可看成由D通过氧化得到。工业生产中在第⑤步氧化的前后设计④和⑥两步的目的是 。
(4)H的结构简式是 。
Ⅱ.已知,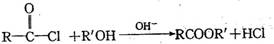
利用本题中的信息,设计合理方案由
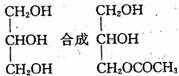 (用反应流程图表示,并注明反应条件)。
(用反应流程图表示,并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为
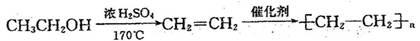
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com