
18.(7分)某课外研究小组,用含有较多杂质的铜粉制取胆固。其设计的实验过程如下;

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上,(填写下列仪器编号,下同),取用坩埚应使用 ,灼烧后的坩埚应放在
上。
A.蒸发皿 B.石棉网 C.泥三角 D.表面皿
E.坩埚钳 F.试管夹
(2)同粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热、同氧气、过滤、
、冷却结晶、 、洗涤、自然干燥。
(3)在测定所得胆矾[CuSO4·xH2O]中结晶水x值的实验过程中,称量操作至少进行 次
17.下列是中学化学实验中常见的实验仪器。
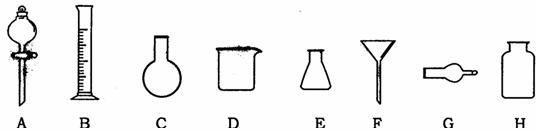
(1)下列实验中,上述仪器被正确选用的是 ;
①用B量取8.80mL稀硫酸
②乙酸乙酯与饱和Na2CO3溶液的分离常用A
③干燥氨气需用G或H
④石油的分馏需用C
⑤粗盐提纯需用F和D
(2)下列有关实验叙述,不正确的是 ;
①铜片和稀硝酸反应产生的气体只能用排水法收集
②用碱式滴定管盛装酸性KMnO4溶液滴定KI溶液
③蒸干、灼烧CuSO4溶液得到无水硫酸铜
④制备Fe(OH)3胶体,将饱和FeCl3溶液加入到沸水中,不断加热
⑤实验室制取乙烯,温度计插入反应物溶液中
16.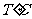 时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是 ( )
时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是 ( )
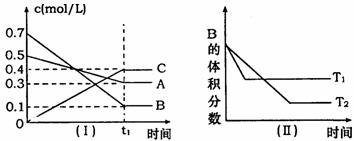
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.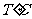 时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L
时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L
D.(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动
|
15.某共价化合物含碳、氢、氮三种元素,分子中共有四个氮原子,且都位于正四面体的顶点,每两个氮原子间都有一个碳原子。已知分子内无碳碳单键,也没有碳碳双键,则该化合物的分子式为 ( )
A.CH8N4 B.C4H8N4 C.C6H10N4 D.C6H12N4
14.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中,下列关于这两种有机物的叙述正确的是 ( )
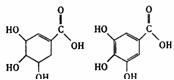
A.两种酸都能和溴水反应
B.两种酸遇三氯化铁溶液都显紫色
C.鞣酸分子与莽草酸分子相比多两个碳碳双键
D.等物质的量的两种酸与NaOH反应,消耗NaOH的量相同
13.常温下,按下列操作进行实验,所得溶液的pH一定等于7的是 ( )
A.将1mLpH=5的稀盐酸加水稀释到100mL
B.0.1mol·L-1的某二元酸和0.1mol·L-1的某二元强碱等体积混合
C.pH=2的某一元酸和 pH=12的某一元碱等体积混合
D.pH=2的某二元强酸和pH=12的某一元强碱等体积混合
12.可用下图装置制取(必要时可加热)、净化、收集的气体是 ( )
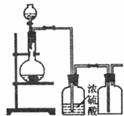
①锌和稀硫酸制氢气 ②双氧水和二氧化锰制氧气 ③浓氨水和生石灰制氨气
④铜和稀NHO3制NO ⑤MnO2和浓盐酸制氯气 ⑥乙醇和浓H2SO4制乙烯
A.①②③ B.④⑤⑥ C.② D.④⑥
11.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断: ( )
①都是主族元素,原子的最外层电子数都大于4
②单质在反应中都只能做氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反映生成酸
A.有①②正确 B.只有①③正确 C.只有③④正确 D.①②③④均不正确
9.下列关于反映能量的说法正确的是 ( )
A.CaCO3(s)======CaO(s)+CO2(g);△H = +178.5kJ·mol-1,反应物总能量大于生成物总能量
B.Zn(s)+CuSO4(aq)======ZnSO4(aq)+Cu(s);△H = -206kJ·mol-1,反应物的总能量大于生成物的总能量
C.H+(aq)+ OH-(aq)======H2O(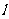 );△H = -57.3kJ·mol-1,含1mlNaOH的稀溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
);△H = -57.3kJ·mol-1,含1mlNaOH的稀溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
D.101Kpa时,2H2(g)+O2(g)
======2H2O(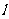 );
);
△H = -571.6J·mol-1,H2的燃烧热为571.6kJ·mol-1
|
A.少量的苛性钠溶液加入到Ca(HCO3)2溶液中:
Ca2+ +2HCO3 +2OH- ======CaCO3+COCO32- +2H2O
B.用氨水吸收过量二氧化硫:NH3·H2O+SO2======NH4+ + HSO3-
C.金属钠加入硫酸铜溶液:2Na+Cu2+ +2H2O=====Cu(OH)2↓+ 2Na+ +H2↑
D.过量的铁加入一定量的稀硝酸中:3Fe+8H+ +2NO3 -=====3Fe2++2NO↑+4H2O
8.亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2。酸性KMnO4溶液与亚硝酸钠反应的离子反应为:MnO4- + NO2- +H+ ===== Mn2+ + NO3-+H2O(未配平),下列叙述错误的是 ( )
A.成1molMn2+,转移电子为5mol
B.该反应中氮元素被氧化
C.配平后,水的化学计量数为3
D.反应中氧化物与还原产物的物质的量之比为2∶5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com