
24.(11 分 )铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
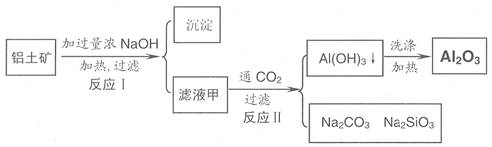
(1)滤液甲的主要成分是
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
a.AlO2― 或 Al(OH)4- b.OH― C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。写出阴极的电极反应方程式 ,沉淀消失的原因可用离子方程式表示为:
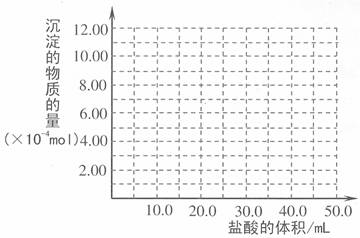
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。
23. (11分 )海波 (Na2S2O3•5H2O) 可用作脱氯剂、定影剂、解毒剂。硫粉和亚硫酸纳溶液煮沸可制得 Na2S2O3•5H2O;Na2S2O3•5H2O的部分性质见下表:
|
物理性质 |
易溶于水,不溶于乙醇;熔点 48.2℃;在潮湿的空气中易潮解 |
|
化学性质 |
43℃以上的空气中易风化;遇酸易分解 (S2O32―+2H+=S↓+SO2↑+H2O
) |
实验室制备海波过程如下:
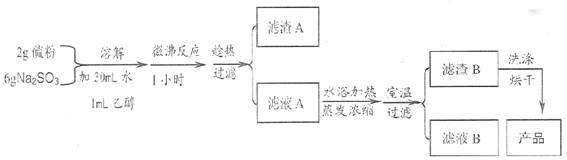
(1)实验开始时,加入1 mL C2H5OH 的目的是
(2)滤液 A 中除有Na2S2O3和少量 Na2SO3 外,最可能存在的无机化合物杂质是
, 如果滤液中该杂质的含量不很低,其检测的方法是
(3)过滤操作所用的玻璃仪器有 , 过滤后发现滤渣 B 中有少量淡黄色物质。为除去淡黄色物质,洗涤滤渣 B 的操作过程是
(4)烘干滤渣 B 时应注意什么问题 ,原因是
22. (12 分 )某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol•L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如下图所示,请读出实验数据,填入下列表格中
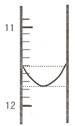
|
序号 |
第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
|
I |
? |
26.85 |
|
II |
10.02 |
25.02 |
|
III |
9.98 |
24.98 |
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
21. (7分)为确定某液态有机物X(分子式为 C2H6O2)的结构,某同学准备按下列程序进行探究。请完成下列填空。己知:①一个碳上连两个羟基的物质 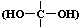 不稳定; ②分子中不存在过氧键 (-O-O一 ) 。
不稳定; ②分子中不存在过氧键 (-O-O一 ) 。
(1)根据价键理论预测 X 的可能结构为 、 、 (横线可不填满)
(2)设计实验方案证明 X 的结构 ( 表格可不填满 )
|
实验原理 |
预期生成H2的体积(标准状况) |
对应X的结构简式 |
|
取6.2gX与足量钠反应,通过生成氢气的体积来确定X分子中能与金属钠反应的氢原子数目,进而确定X的结构 |
|
|
|
|
|
|
|
|
|
|
|
|
|
(3)根据实验方案,从下列仪器中选择所需仪器,画出实验装置图:

要求:①本题装置示意图中的仪器可以用上面的方式表示
②铁架台、石棉网、酒精灯、连接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,用“△” 表示。
20.标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2, 所得溶液 pH 变化如图所示。下列分析中,正确的是 ( )
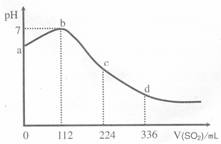
A.ab 段反应是:SO2 + 2 H2S=3S↓+2 H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol•L-1
D.b 点对应的溶液导电性最强
19.Na2O2、HCl、Al2O3 三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl―、OH―;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 ( )
A.3:2:1 B.2:4:1 C.2:3:1 D.4:2:1
18.某无色气体可能含有 CO2、CO、H2、H2O(g) 中的一种或几种,依次进行以下处理 (每步反应均进行完全)。①通过赤热的炭层后,恢复到原状态,气体体积不变;②通过灼热的 CuO 时,固体变红色;③通过白色 CuSO4 粉末时,粉末变蓝色;④通入澄清石灰水中,石灰水变浑浊。下列判断中,正确的是 ( )
A.原混合气体中一定没有 CO2、H2O, 一定含有H2和CO
B.①②③④中都发生了氧化还原反应
C.③中的反应为:CO2+3H2O+2CuSO4=Cu2(OH)2CO3+2H2SO4
D.由①④说明,实验过程中一定有 CO2 生成
17.“XYn”表示不同卤素之间靠共用电子对形成的卤素互化物 (非金属性:X<Y), 其化学性质和卤素单质相似。下列说法中,正确的是 ( )
A.ICl与水反应可生成 HCl 和 HIO,则1mol ICI 参加反应转移电子为 1mol
B.某温度,液态 IF5电离:2IF5≒ IF4+ +IF6-, 则 c (IF4+)×c (IF6-) 是一个常数
C.BrCl与 Zn 反应生成 ZnCl2 和 ZnBr2
D.XYn 与卤素单质一样都是非极性分子
16.下列说法中,正确的是 ( )
A. 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大
B. AgCl悬浊液中存在平衡: AgCl(s)≒Ag+(aq)+Cl―r(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
C. AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl) > Ksp(AgI)
D.硬水含有较多Ca2+、Mg2+、HCO3―、SO42―,加热煮沸可以完全除去其中的Ca2+、Mg2+
15.用酸性氢氧燃料电池电解苦卤水 (含Cl―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是 ( )
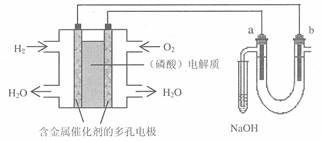
A. 电池工作时,正极反应式为:O2 +2 H2O + 4e-=4 OH―
B. 电解时,a 电极周围首先放电的是Br―而不是Cl―,说明当其它条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com