
11.下列实验操作错误的是 ( )
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制浓硫酸与浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中,并及时搅拌和冷却
D.欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶
液滴在试纸上,并与标准比色卡比较
9.下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的是 ( )
A.Mg2+、Ba2+、NO3-、CO32- B.Na+、Al3+、Ba2+、Cl=
C.K+、Ba2+、Cl-、HCO3- D.NH4+、Ca2+、Fe3+、NO3-
|
A.Zn B.Al C.Mg D.Cu
8.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子半径A>B>C>D B.离子半径C>D>B>A
C.原子序数d>c>b>a D.单质的还原性B>A>D>C
7.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,22.4L戊烷所含分子数为NA
B.10L 0.1mol/L NH4Cl溶液中所含NH4+数目为NA
C.12g金刚石晶体中含有碳碳键的数目为4NA
D.46g四氧化二氮和二氧化氮的混合物中含有的原子总数一定为3NA
6.三峡工程是目前世界上最大的水利枢纽工程。它所提供的清洁、廉价、可再生的水电,相当于每年燃烧5000万吨原煤的火力发电厂生产的电能,因此三峡工程的建成和使用有助于控制 ( )
①氮氧化物的排放 ②酸雨的形成 ③臭氧空洞扩大 ④温室效应 ⑤白色污染
A.①④ B.②④ C.③④ D.①②⑤
29.(10 分 )氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧( ) 和镍(
) 和镍(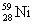 ) 的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
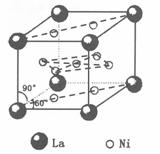
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
E. 己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
|

①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
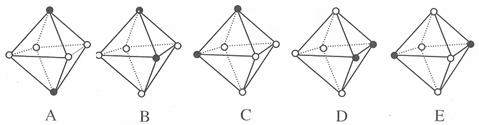
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
28.(10分)阿司匹林能迅速解热、镇痛和消炎。长效缓释阿司匹林可在人体内逐步水解使疗效更佳。用苯酚和丙酮为主要原料合成长效缓释阿司匹林的流程如下图。
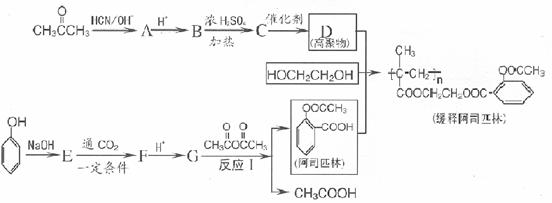
回答下列问题:
(1)G 的结构简式为: 反应 I 的反应类型为 。
(2)写出 B→C 的化学反应方程式: 。
(3)下列物质与阿司匹林互为同分异构体的有 (填字母编号 ) 。
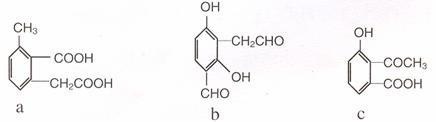
(4)依据提示信息,模仿以上流程图设计合成路线,以苯酚为主要原料合成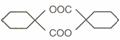 ,标明每一部的反应物及反应条件(有机物写结构简式,其他原料自选 )
,标明每一部的反应物及反应条件(有机物写结构简式,其他原料自选 )
27.(10 分 )糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖 ( C6H12O6)。下列说法正确的是 ( 错选倒扣分 )
A.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇 [ CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后不会升高血糖。请预测木糖醇的一种化学性质 ( 写反应方程式 ):
(3)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物 A。A 的实验结果如下:
I、通过样品的质谱测得 A 的相对分子质量为 60
II、核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值 (信号),根据 峰值 (信号) 可以确定分子中氢原子的种类和数目。例如:乙醇 (CH3CH2OH) 有三种氢原子 (图1)。经测定,有机物 A 的核磁共振氢谱示意图如图2
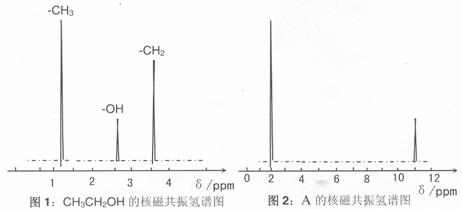
III、将 A 溶于水,滴入石器试液,发现溶液变红。
试推导写出 A 的结构简式为 。
(4)糖尿病人宜多吃蔬菜和豆类食品。蔬菜中富含纤维素,豆类食品中富含蛋白质。下列说法错误的是: (填序号,错选倒扣分)
A.蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
(5)香蕉属于高糖水果,糖尿病人不宜食用。乙烯是香蕉的催熟剂,可使澳的四氯化碳溶液褪色,试写出该反应的化学方程式:
26.(12 分 )金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平方程式:口 Na2FeO2+ 口 NaNO2+ 口 = 口 NaFeO2+ 口 NH3↑+ 口 NaOH
(2)钢铁的“钝化”处理也能达到防腐目的,经冷、浓 HNO3 处理后,其表面有一层致密氧化物保护膜,但是加热或在稀HNO3中 就不能 “钝化”。不同浓度的HNO3 与铁反应的还原产物很复杂,其分布曲线如图。
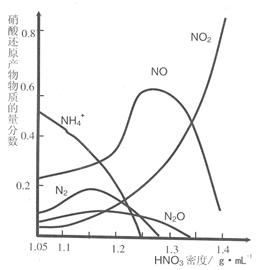
①图示可知,密度为 1.05g·mL-1 的硝酸与铁反应时,其最多的还原产物是
;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是: 。
② mg 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO, 则 m 的取值可能是 (填字母编号 )
A.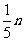 B.
B.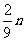 C.
C.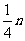 D.
D.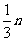 E.
E.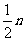
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
(3)金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
25.(7 分 )水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)≒CO (g) +H2 (g);△H =+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器 编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
V正、V逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
V正=V逆 |
|
II |
0.06 |
0.50 |
0.40 |
? |
|
III |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
IV |
0.12 |
0.30 |
? |
V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为 。
(3)己知:C (s)
+ 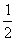 O2(g)=CO (g);△H = -110.5kJ·mo1-1
O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + 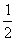 O2(g) =CO2 (g);△H
=-283.0 kJ·mo1-1
O2(g) =CO2 (g);△H
=-283.0 kJ·mo1-1
H2 (g) + 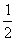 O2 (g) =H2O (g);△H
= -241.8kJ·mo1-1
O2 (g) =H2O (g);△H
= -241.8kJ·mo1-1
那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ·mo1-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com