
11.在一个固定容积的密闭容器中,加入m molA、n molB发生下列反应:2A(g)+B(g)
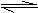 3C(g),平衡时C的百分含量为W%。若维持容器体积和温度不变,起始时放入amolA、bmolB、cmolC,要使平衡后C的百分含量仍为W%,则下列有关a、b、c的关系正确的是 ( )
3C(g),平衡时C的百分含量为W%。若维持容器体积和温度不变,起始时放入amolA、bmolB、cmolC,要使平衡后C的百分含量仍为W%,则下列有关a、b、c的关系正确的是 ( )
①a:b=m:n ②a:b=m:n 3a/2+c=3
③2c/3+a=2:3c+b=1 ④a=m/3:b=n/3;c=2
A.①②③ B.①②④ C.①③④ D.②③④
9.a、b、c、d、e分别为MgC12、KHSO4、KOH、NaHCO3、A1C13溶液中的一种,已知:
①a能与其他4种溶液反应,且a与c、e反应时有明显现象;
②b与d反应只产生气泡;
③e只能与a反应;下列推理不正确的是 ( )
A.a一定是KOH B.c一定是A1C13 C.e一定是MgC12 D.b一定是KHSO4
|
|
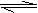 A.向沸水中滴加FeC13溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3+3H+
A.向沸水中滴加FeC13溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3+3H+
B.实验室用浓盐酸与MnO2反应制C12:MnO2+2H++2C1- C12+Mn2++H2O
C.用FeC13溶液腐蚀印刷电路板:Fe3++Cu Fe2++Cu2+
|
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
8.下列实验操作正确的是 ( )
A.向过量稀硫酸中加入除去油污的废铁屑,是制备硫酸亚铁的可行方案
B.向碳酸钠粉末中加入二酸溶液,生成大量气泡,说明乙二酸的酸性比碳酸强
C.向铝屑与硫酸反应后的溶液中加入氧氧化钠溶液,是制备氢氧化铝的最佳方案。
D.向硫酸亚铁铵溶液中,依次加入氯水和硫氰化钾溶液,溶液变化,说明溶液中含有Fe2+
7.下列说法正确的是 ( )
A.同主族元素单质的熔点从上到下逐渐增高
B.CC14熔点比CF4的熔点高,是由于它们的晶体类型不同
C.非金属单质形成晶体不一定都是分子晶体
D.由于水分子之间存在氢键,所以水分子比较稳定
6.生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是 ( )
A.“加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质
B.“酸可以除锈”,“热纯碱溶液去油污” 都是发生了化学变化
C.医疗上进行胃部造影前,患者服用的“钡餐”BaCO3等不溶于水的物质
D.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
29.(15分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/cm3,遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应(该反应为放热反应)合成二氯化硫的实验装置。
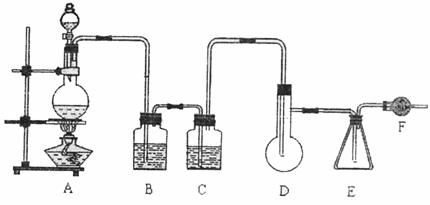
试填写下列空白:
(1)装置A中发生反应的离子方程式为: ,装置B盛放的药品是 ,C中盛放的药品是 。
(2)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(3)实验时,D装置需将加热温度控制在50℃-59℃,最好采用 加热。为了防止E中所得液体挥发,采用的措施是 。
(4)F装置的作用是: 。
(5)由SCl2与SO3作用生成SOCl2的化学方程式为: 。
28.(15分)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一。
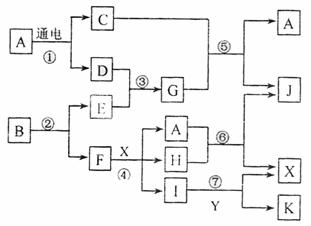
请按要求填空:
(1)写出下列物质的化学式
A 、E 、Y
(2)反应⑤的化学方程式为: 。
(3)常温下,G和X反应生成Z,写出鉴定Z中阳离子的实验方法和现象:
。
(4)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为
。
27.(18分)(1)在20L恒容的密闭容器中,加入3molSO3(g)和1molO2(g),在一定温度下使其反应,反应至4min时,O2的浓度为0.08mol/L,当反应进行到8min时,反应达到平衡,此时SO3的浓度c(SO3)=amol/L。
①0min-4min内生成O2的平均速率为v(O2)= mol·L-1·min-1
②达到平衡时,c(O2)=c(SO2),则a= 。在下图(左图)坐标系中作出0min-8min及之后O2、SO3浓度随时间变化的曲线。
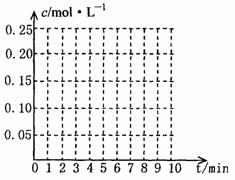
27题(1)小题 27题(2)小题
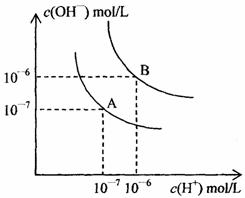
(2)水的电离平衡曲线如上图(右图)所示:
①若以A点表示25℃时水的电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。造成水的离子积增大的原因是 。
②100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液和硫酸溶液的体积比为 ,此溶液中各种离子浓度由大到小排列的顺序是 。
13.甲、乙 两烧杯中各盛有100mL浓度为3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体的体积之比为3∶4,则加入铝粉的质量为
( )
A.5.4g B.3.6g C.2.7g D.1.8g
|
(1)乙元素原子结构示意图为 ,丙、丁两元素形成的常见化合物的电子式为 。
(2)甲、乙、丁可形成A、B两种微粒,它们均为-1价双原子阴离子,且A有18个电子,B有10个电子,则A和B反应的离子方程式为 。
(3)1L 0.5mol/L丙的最高价氧化物的水化物与1L 0.5mol/L丁的最高价氧化物的水化物反应,放出28.65kJ热量,该反应的热化学方程式为
。
(4)将丁单质与戊单质的水溶液充分反应可以生成两种强酸,该反应的化学方程式为
。
12. 高铁电池是一种新型可充电电池,其电池的总反应为:
高铁电池是一种新型可充电电池,其电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是 ( )
A.放电时负极反应为:3Zn-6e-+6OH-=3Zn(OH)2
B.充电时阳极反应为:2Fe(OH)3+10OH――6e=2FeO42-+8H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com