
13.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列四个电极反应:
①Br2+2e-=2Br- ②2Br――2e-=Br2 ③Zn-2e-=Zn2+ ④Zn2++2e-=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别 ( )
A.②和① B.②和③ C.③和① D.④和①
12.下列各组离子中,在碱性溶液中共存,在加入盐酸过程中产生气体和沉淀的是( )
A.Na+、NO3-、Al3+、SO42- B.K+、NO3-、Na+、SiO32-
C.Na+、Br-、AlO2、S2- D.SO42-、HCO3-、Ca2+、NH4+
11.设NA为阿伏加德罗常数,下列说法不正确的是 ( )
A.11.2L Cl2通入足量的NaOH溶液中,转移的电子数一定为0.5 NA
B.常温常压下,46g二氧化氮和四氧化二氮的混合气体含有的原子数为3 NA
C.1 L 1mol·L-的醋酸溶液中,所含醋酸分子数小于NA
D.17g羟基中含有的电子数为9 NA
9.2007年12月22日,沉睡在海底800余年的南宋时古沉船“南海一号”被成功打捞,谱写了我国考古工作的新篇章。下列叙述中不正确的是 ( )
A.出水的大量瓷器为传统的硅酸盐产品
B.古船保存得较为完好的原因之一是沉没后很快为淤泥所覆盖
C.随船沉浸在海中的铜、银等古钱币和铁制品,以铁制品被腐蚀的最厉害
D.据推测,为“南海一号”提供动力的物质是“可燃冰”
|
A.1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应一共需要氯气6mol
B.乙烯、苯都能使溴水褪色,但两者褪色原理不相同
C.高分子化合物的单体中一定含有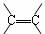 结构
结构
D.糖类都可以用通式Cn(H2O)m来表示
28.(15分)工业制纯碱的第一点是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸
氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3+CO2+H2O+NaCl(饱和)=== NaHCO3(晶体)↓+NH4Cl
(1)某校学生实验小组利用上述反应原理,设计如图1所示装置,制取碳酸氢钠晶可选用的药品有: a.石灰石b.生石灰c.6mol/L盐酸d.稀硫酸e.浓氨水f.饱和氯化钠溶液。
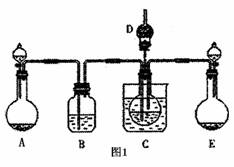
①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图2所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号)
;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
|
|
|
2KClO3 2KCl+3O2↑,4Al+3O2 2Al2O3,3CuO+2Al 3Cu+Al2O3
反应完全后得到混合物乙。
①向混合物乙中加入稀盐酸至固体不再溶解,恰好用去200mL 3mol/L盐酸,反应中无气体产生,结果得到无色溶液丙和不溶物丁,然后过滤。
②将溶液丙加热,蒸干并灼烧得到固体戊,且戊的质量和甲的质量恰好相等。
回答下列问题:
(1)写出不溶物丁的化学式 ;
写出①中反应的离子方程式: ;
(2)甲中铝粉的质量为 g,KClO3的物质的量为 mol;
(3)溶液丙中所有离子浓度由大到小顺序为 。
27.(15分)
已知A、B、C、D、E、F、G七种物质有如下转化关系。A、B、C、E都是由两种元素组成的化合物,D、F、G在常温下分别是固态、液态、气态单质,D、F的组成元素在周期表中位于同一主族。E溶液为浅绿色,与NaOH溶液反应生成的白色沉淀极易被氧化。
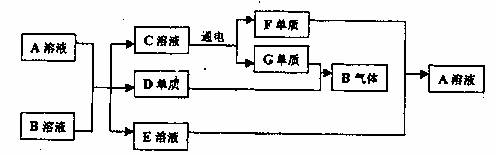
试回答下列问题:
(1)写出A与B反应的化学方程式 。
(2)写出E溶液与F单质反应的离子方程式 。
(3)检验A中阳离子最常用的试剂可用一种钾盐,其化学式为 。
(4)实验室制得的B所体,不能用浓硫酸作干燥剂,其原因是 。
(5)用惰性电极电解C溶液,其阳极反应为 ,当转移1mole时在阴极可收集到气体的体积为 L(标准状况下)
(6)将2mol 气体B放入某固定容积的密闭容器中,在一定温度下反应达到平衡,测得D蒸气的体积分数为40%。若其它条件不就,再向该容器中充入2mol气体B,当体系的颜色不再变化时D蒸气的体积分数 (填“大于”、“小于”、“等于”)40%。
26.(16分)A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C相邻,C的最外层电子数是其电子总数的3/4,D能分别与A、B、C形成电子总数相符的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中稳定性由强到弱的顺序是(用化学式表示,下同)
,Z的电子式是 。
(2)常温下8gX完全燃烧生成液态水和CO2,放出热量akJ,写出表示X燃烧热的热化学方程式 。
(3)将Y溶于水所得溶液与适量AlCl3溶液反应,其离子方程式是 。
(4)若由A、B、C、D四种元素组成一种离子化合物,1mol该化合物中含有10mol原子,则该化合物受热分解的化学方程式为 。
(5)Y跟HCl反应生成固体。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2被完全破坏,当有1molNaNO2发生反应时,共有3mol电子转移,该反应的化学方程式 。
14.下列说法正确的是 ( )
A.布朗运动反映了布朗微粒中分子运动的不规则性
B.对不同种类的物体,只要温度相同,分子的平均动能一定相同
C.分子间距离增大时,分子间的引力增大而斥力减小
D.一定质量的气体,温度升高时,分子间的平均距离一定增大
第Ⅱ卷(非选择题 共174分)
13.下列说法中正确的是 ( )
A.体积相同、pH值相同的①盐酸②硫酸③醋酸,被NaOH 溶液完全中和,消耗上述溶液的体积由小到大的顺序是②<①<③
B.25℃时,0.1mol·L-1氨水和0.05mol·L-1氨水中c(OH-)之比是2:1
C.25℃时,向CH3COONa溶液中加入适量CH3COOH使混合液pH=7,此时溶液中c(Na+)=c(CH3COO-)
D.向含有HCO3-、CH3COO-、CO32-、SO32-离子的溶液中加入足量的Na2O2固体后,假设溶液体积不变,则以上四种离子浓度基本保持不变的是CO32-和CH3COO-
12.关于下列装置图的叙述中,不正确的是 ( )
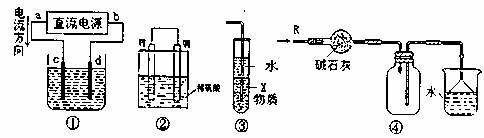
A.若采用装置①煤炼铜,则d为粗铜,c为极纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com