
8.下列关于IA族和IIA族元素的说法正确的是( )
A.IA族和IIA族的元素均为金属元素
B.在同一周期中,单质与水反应,IA族比IIA族剧烈
C.在同一周期中,单质的熔点,IA族比IIA族高
D.IA族与IIA族阳离子核外电子排布与同周期的稀有气体原子相同
7.下图是制取和收集气体的实验装置,该装置可用于 ( )
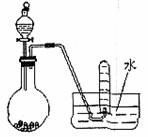
A.用浓盐酸跟二氧化锰反应制取Cl2
B.用浓氨水和生石灰制取NH3
C.用电石跟水反应制取C2H2
D.用浓硝酸跟铜反应制取NO2
6.下列各组物质的分类正确的是 ( )
A.同位素:1H、D+、T2
B.电解质:H2O、CH3COOH、NH4HCO3
C.非极性分子:C60、CO2、CH2Cl2
D.同系物: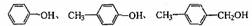
5.为保障人体健康,必须严格限制用量的是 ( )
A.用SO2漂白食品 B.用小苏打制作糕点
C.用食醋清洗热水瓶胆内壁附着的水垢 D.用O3对游泳池中的水进行消毒
9.下列反应过程中,同时有离子键.极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl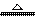 NH3↑+HCl↑ B.NH3+CO2+H2O=NH4HCO3
NH3↑+HCl↑ B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O D.2Na2O2+2CO2=2Na2CO3+O2
10.如下图所示,表示反应2SO2(g)+O2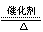 2SO3(g)
,△H<0的正反应速率随时间的变化曲线,试根据此曲线判断下列说法可能正确的是( )
2SO3(g)
,△H<0的正反应速率随时间的变化曲线,试根据此曲线判断下列说法可能正确的是( )
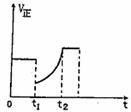
A.t1时增加了SO2和O2的浓度,平衡向正反应方向移动;
B.t1降低了温度,平衡向正反应方向移动;
C.t1时减小了压强,平衡向逆反应方向移动;
D.t1进减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应方向移动
11.将0.2mol/LNaA溶液和0.1mol/L盐酸等体积混合后,溶液pH<7,则以下关系式错误的是 ( )
A.c(HA)+c(A-)=0.1mol/L
B.c(A)>c(HA)
C.c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-)
D.c(Na+)=c(A-)=c(HA)
12.在Cu2S+2Cu2O=6Cu+SO2反应中,说法正确的是 ( )
A.生成1molCu ,转移2 mol 电子 B.Cu是氧化产物
C.氧化剂只有Cu2O D.Cu2S既是氧化剂又是还原剂
13.在一密闭容器在中有HCHO.H2.O2混合气体共20克和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重8克,则原混合气体中O2的质量分数是 ( )
A.40% B.33.3% C.60% D.36%
第Ⅱ卷(非选择题,共174分)
本卷共10道题。填空题一需写出深处步骤,解答题应写出必要的文字说明.方程式和重要的深处步骤,只写出最后答案的不能得分。有数值计算的题,答案中必须明确写出数值和单位
26.(15分)有原子序数依次增大的4种短周期元素X.Y.Z.W,已知:①X与Z.Y与W分别同主族;②X.Z.W分别与Y都能形成两种常见的化合物;③Y的阴离子与Z的阳离子的核外电子排布相同,试根据以上叙述填空。
(1)写出由Y与Z形成的化合物Z2Y2的电子式 ,Y与W形成的在常温下为无色固体的化合物的化学式
(2)写出由X.Z.W三种元素组成的盐溶于水呈碱性的离子方程式
(3)写出均由这4种元素组成的两种化合物在水溶液中发生反应的离子方程式
(4)X、Y两种元素的单质已被应用于飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通往的两种单质由孔隙逸出并在电极表面放电。
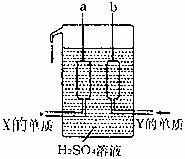
①a是电池的 极
②b电极上的电极反应式是
27.(16分)在750℃时,用过量的氧气流将样品氧化成CO2和H2O,再根据CO2和H2O的质量求出有机物中碳和投的质量分数。现用下列各仪器装置来确定乙炔分子中碳.氢两种元素的质量比。
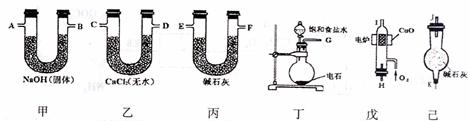
回答下列问题:
(1)若产生的气体由左向右流向,各装置导管的连接顺序是G接E.F接 .
接 . 接A.B接J。
(2)装置甲的作用是 ;装置丙的作用是 ;装置已的作用是
(3)装置丁中的化学方程式 ;
装置戊中的化学方程式
(4)实验前称得甲.乙两装置的质量分别为m1g和n1g,实验完毕,称得甲.乙两装置的质量分别变为m2g和n2g,则乙炔分子中碳原子和氢原子的原子个数比为(列算式)
28.(15分)已知甲.乙.丙均为常见的气态单质,丁是一种常见金属,丙和丁均可在甲和乙中燃烧分别生成X.Y.Z.W化合物,且W的水溶液呈棕黄色。转化关系如图所示。请回答:
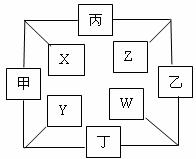
(1)根据图示关系写出下列物质相应的化学式:
乙: ;丙: ;丁:
(2)将少量W的饱和溶液滴入沸水中,反应的化学方程式为:
(3)写出由Y和某金属反应制取丁的化学方程式:
(4)若在一定条件下丁分别与发生X.Z发生反应生成等物质的量的气体,则消耗丁的物质的量之比是:
29.(14分)苯佐卡因是一种局部麻醉剂,可用于粘膜溃疡.创面及痔疮的镇痛,一般制成软膏或栓剂使用。其合成路线如图,其中有机物B具有酸性。
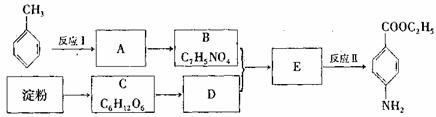
已知:①苯环上的取代有如下定位规律:当苯环上的碳原子连有甲基时,可在其邻位或对位上引入官能团;当苯环上的碳原子连有羧基进,可在其间位引入官能团。
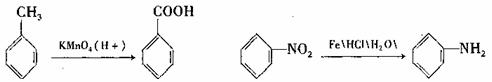
请写出:
(1)反应类型:反应Ⅰ: ,反应Ⅱ
(2)下列转化的化学方程式:
C→D
B+D→E
(3)苯佐卡因有多种同分异构体,其中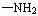 直接连在苯环上,分子结构中含有
直接连在苯环上,分子结构中含有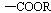 (R为饱和的链烃基)官能团,且苯环上的一氯取代物只有两种的同分异构体共有6种,除苯佐卡因外,其中3种的结构简式是:
(R为饱和的链烃基)官能团,且苯环上的一氯取代物只有两种的同分异构体共有6种,除苯佐卡因外,其中3种的结构简式是:
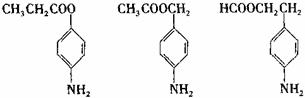
则剩余两种同分异构体的结构简式为 . 。
8.下列离子方程式书写正确的是 ( )
A.氨气通往醋酸溶液:CH3COOH+NH3 = CH3COONH4
B.澄清石灰水与少量小苏打游泳混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.金属钠跟水反应:Na+2H2O=Na++2OH-+H2↑
D.次氯酸钙溶液通往过量的SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+2HClO
7.设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.任何气体单质在状况下体积为22.4L,则含有2NA个原子
B.13g13C所含的质子数为13NA
C.23g钠与足量氧气充分反应,转移的电子数为NA个
D.在1L 1mol/LNa2S溶液中,含有NA个S2-
6.2008年第29届夏季奥运会在北京举办,为向世界展现中国的新形象,以下建议你认为不可以采纳的是 ( )
A.大型庆典活动时,用数万只氢气气球腾空而起,以增添活动气氛
B.开发新能源,减少化石燃料的燃烧
C.分类回收垃圾
D.开发.生产环保材料,以投入体育场馆建设
29.(16分)A、B均为离子化合物,C、D、E、G为短周期元素形成的单质,常温下D、G为气体。C、G的组成元素同周期,L是目前应用最广泛的金属,在化合物K中含有组成单质L的元素,且该种元素的质量分数为70%。各物质间有如下转化关系(部分产物略去):
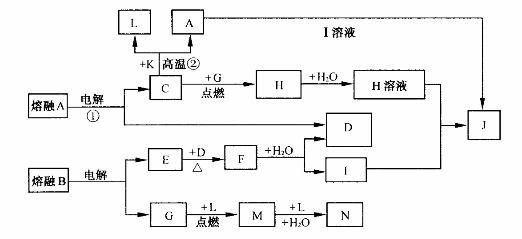
请回答下列问题:
(1)写出反应①的化学方程式: ;
(2)反应②通常叫作 ,该反应原理常用于 ,
该反应通常得到的是C和L的熔融物,常温下,在实验室欲溶解此物质,最好选用 (填序号);
A.稀硝酸 B.稀硫酸 C.浓硫酸 D.NaOH溶液
(3)J的化学式为 ;组成D的元素与氢元素可形成一种弱酸性化合物,该化合物用结构式可表示为 ;
(4)将D通入含有N的水溶液中,其离子方程式为 。
(5)将a g CH4、CO、H2混合气体完全燃烧的产物全部通人到足量固体F中,充分反应,测得F增重m g,则m的取值范围为 。
28.(18分)下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
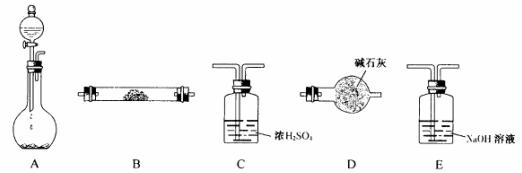
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是 、 (写化学式);
D装置的作用是 。
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有 、
等。
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3。能产生大量NH3的原因是:
a ;
b ;
c ;
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是: (将正确序号的字母填在方框内)
(将正确序号的字母填在方框内)
此时在其中的一个装置中可能会出现大量红棕色气体,该装置是 (用字母表示);用化学方程式解释红棕色气体产生的原因: 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com