
27.请按要求填空:(18分)
(1)下列操作正确的是_________、___________。(填编号)
A.将未经湿润的pH试纸浸到某溶液中,之后取出与标准比色卡比较,测得该溶液pH
B.制备时Fe(OH)2,将盛NaOH(aq)的滴管伸入到试管内FeSO4(aq)的液面下
C.焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后直接蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色
D.中和滴定中,锥形瓶用蒸馏水洗净后未干燥直接往其中注入一定量的待测溶液
E.各放一张质量相同的滤纸于天平的托盘上,将NaOH固体放在左盘纸上称量
F.配置0.1mol-1L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
G.用盐酸析法去淀粉溶液中混有的NaCl杂质
(2)实验室模拟合成氨和按催化氧化的流程如下:
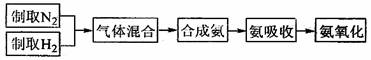
下图为实验过程中用到的部分实验装置:

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
①从图中选择制取气体的适合装置:氮气_____________、氢气_____________。
②氮气和氢气通过甲装置,甲装置的作用除了将气体干燥外,还有___________ _
__________________的作用。
③用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到红棕色气体和白烟产生。
④写出乙装置中氨氧化的化学方程式:_________________________。
⑤反应结束后锥形瓶内的溶液中含有H+、OH-、__________、__________离子
26.(12分)A、B、C、D、E是原子序数依次增大的短周期主族元素,且互不同族;其中只有两种为金属;A原子的 最外层电子数与次外层电子数相等;A与E、B与D这两对原子的最外层电子数之和均为i9.五种元素的单质在一定条件下都可与NaOH溶液反应,C元素在地壳中的含量占第二位。请回答下列问题:
(1)B、D、E的原子半径由小到大的顺序是_______________(用元素符号表示)
(2)DE2的电子式是______________,它在常温下呈液态,形成晶体时,属于___________晶体。
(3)A与B化学性质相似,则A与浓的NaOH溶液反应的化学方程式是:_____________。
(4)硅酸盐工业用C的氧化物在玻璃窑中的两个主要反应方程式:____________。
13.a g 铁粉与含有H2SO4 的CuSO4溶液完全反应后,铁完全消失,并得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为: ( )
A.1:7 B.7:1 C.7:8 D.8:7
第Ⅱ卷 (共10大题,共174分)
12.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是 ( )
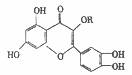
A.可以和溴水反应
B.1mol维生素P最多可以和8molH2加成
C.分子中有三个苯环
D.1mol维生素P可以和4molNaOH反应
11.对于相同体积的溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中CO32-的物质的量浓度相同,则c1和c2的关系是 ( )
A.c1=2c2 B.c1>c2 C.c1=c2 D.c1<c2
9.一种新型的燃料电池,它的多孔镍板为电极插入KOH溶液中,然后分别向两级通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是 ( )
A.负极反应为14H2O+7O2+28eˉ=28OHˉ
B.放电一段时间后,负极周围的pH升高
C.放电过程中KOH的物质的浓度不变
D.每消耗1molC2H6,则电路上转移的电子为14mol
|
A.1L1mol/L的醋酸溶液中离子总数为2NA
B.0.5mol熔融的KHSO4中含有阳离子的数目为0.1NA
C.0.4molNaCl晶体中含有下图所示的结构单元的数目为0.1NA
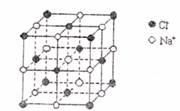
D.标准状况下,22.4LCH2Cl2和CHCl3 的混合物所含有分子数目为NA
8.下列有关比较中,大小顺序排列错误的是 ( )
A.热稳定性:PH3>H2S>HB>NH3
B.物质的熔点:石英>食盐>冰>贡
C.结合质子的能力:CO32->CH3COOˉ>SO42-
D.分散系中分散质粒子的直径;Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
7.下列反应的离子方程式真确的是 ( )
A.向沸水中滴入少量饱和氯化铁溶液 Fe3++3H2O Fe(OH)3↓+3H+
B.漂白粉溶液中通入过量二氧化碳:Ca2++2ClOˉ+H2O+CO2 CaCO3↓+2HClO
C.碳酸氢钠溶液与少量石灰水反应:HC3Oˉ+Ca3++OHˉ CaCO3↓+ H2O
D.氢氧化钠溶液中滴加少量氯化铝溶液:Al3++4OHˉ AlO2ˉ+2H2O
6.有关化学用语正确的是 ( )
A.乙烯的最简式C2H
B.四氯化碳的电子式 
C.用铜为阳极电解硫酸铜液体的阳极反应式:4OHˉ-4eˉ=O2↑+2H2O
D.以知0.5稀硫酸与1mol NaOH稀溶液反应放热57.3KJ,则热化学方程式:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l);△H=-114.6kJ/mol
29.(14分)甲、乙两位同学分别进行“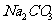 和NaCl混合物中
和NaCl混合物中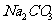 含量测定”的实验:
含量测定”的实验:
(1)甲同学实验的主要步骤有:①过滤 ②加入足量的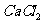 溶液③将沉淀小心烘干、称量,测得固体质量为n g ④称取m g样品溶于适量蒸馏水 ⑤洗涤沉淀2-3次
溶液③将沉淀小心烘干、称量,测得固体质量为n g ④称取m g样品溶于适量蒸馏水 ⑤洗涤沉淀2-3次
该同学正确的操作步骤为 (填番号)
该同学测得的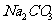 的质量分数为 。
的质量分数为 。
(2)乙同学准确称取w g固体混合物放入锥形瓶中,加入V1 mL0.1000 mol/L盐酸,充分反应后,用0.1000 mol/L的氢氧化钠溶液滴定过量的盐酸,消耗氢氧化钠溶液V2 mL。请回答下列问题:
①实验室现有1.000 mol/L盐酸溶液,为了精确配制100 mL 0.1000 mol/L的盐酸溶液,需要的仪器有:烧杯、玻璃棒、胶头滴管、 、 。
②滴定时选择 作指示剂,达到滴定终点时现象 。
③混合物中碳酸钠的质量分数为 (只需列出计算式即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com