
12.在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法正确的是 ( )
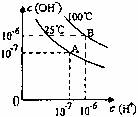
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7
B.25℃时,0.2mol/L Ba(OH)2溶液和0.2mol/L HC1溶液等体积混合,所得溶液的pH等于7
C.25℃时,0.2mol/L NaOH溶液与0.2mol/L乙酸溶液恰好中和,所得溶液的pH等于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7
|
本试卷共11小题,共180分。
11.有下列三个反应:①C12+Fe12 FeC12+I2 ②2Fe2++Br2 2Fe3++2Br-
③Co2O3+6HC1 2CoC12↑+3H2O,下列说法正确的是 ( )
A.①②③中氢化产物分别是FeC12、Fe3+、C12
B.根据以上方程式可以得到氧化性C12>Co2O3>Fe3+
C.在反应③中生成1molC2时,有2molHC1被氧化
D.根据反应①②一定可以推理得到C12+FeBr2 FeC12+Br2
9.在探究下列物质性质或组成的实验中,实验现象与实验结论均正确的是 ( )
|
选项 |
实验内容 |
实验现象 |
实验结论 |
|
A |
将几滴水加入蔗糖中并搅拌,再加入浓硫酸,迅速搅拌 |
蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 |
只体现了浓硫酸的脱水性 |
|
B |
将铜片放入浓硝酸中 |
产生大量无色气体,溶液变为蓝绿色 |
只体现浓硝酸的强氧化性 |
|
C |
溴乙烷和氢氧化溶液充分反应,用足量稀硝酸酸化,再加入硝酸银溶液 |
生成淡黄色沉淀 |
溴乙烷中含有溴元素 |
|
D |
将溴水加入苯中并充分振荡 |
溴水褪色 |
苯与溴发生了取代反应 |
|
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是VIIA族,其氢化物的稳定性大于HC1
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(TI)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③④ B.①③⑥ C.③④⑤ D.②④⑥
8.“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示。下列关于“诺龙”的说法中不正确的是 ( )
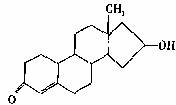
A.分子式是C18H26O2
B.能在NaOH醇溶液中发生消去反应
C.既能发生加成反应,也能发生酯化反应
D.既能发生氧化反应,也能发生还原反应
7.2007年10月10日,德国科学家哈德·埃尔特生日当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究结果,下列关于合成氨反应的叙述中正确的是 ( )
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨气从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动
C.升高温度可加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
6.下列各组离子在溶液中能大量共存,且加入过量NaOH溶液后可得到澄清溶液的是( )
A.Na+、Cu2+、Cl-、SO2-4 B.Al3+、Na+、Cl-、NO-3
C.Ag+、K+、SO2+4、Cl- D.K+、Ba2+、Cl-、HCO-3
5.下列叙述中不正确的是 ( )
A.“水滴石穿”的原因之一是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
B.长期存放NaOH溶液的滴瓶不易打开,是因为NaOH与玻璃中的SiO2反应,其产物将玻璃粘住
C.塑料袋全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解
D.木糖醇(C5H15O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同分异构体
26.已知pH为4-5的条件下,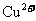 几乎不水解,而
几乎不水解,而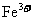 几乎完全水解。某学生用电解纯净 的
几乎完全水解。某学生用电解纯净 的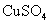 溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V
mL 标准状况)来测定Cu的相对原子质量,过程如下:
溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V
mL 标准状况)来测定Cu的相对原子质量,过程如下:
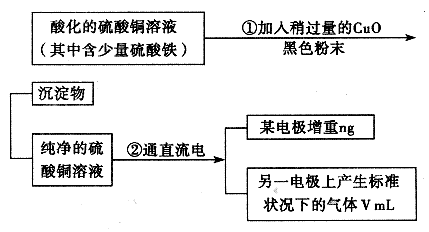
回答下列问题:
(1)加入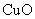 的作用是
的作用是
(2)步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的 和 极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有: 电解的离子方程式为:
(4)下列实验操作中必要的是 (填写字母)
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为 (用带有n、V的计算式表示)。
25.(7分)某液态烃的分子式为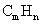 ,相对分子质量为氢气的46倍,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。在催化剂镍存在下,9.2g该烃能与0.3mol氢气发生加成反应,生成饱和烃
,相对分子质量为氢气的46倍,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。在催化剂镍存在下,9.2g该烃能与0.3mol氢气发生加成反应,生成饱和烃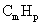 。则:
。则:
(1)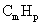 的结构简式是 ,名称是 。
的结构简式是 ,名称是 。
(2)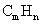 能和浓硫酸、浓硝酸的混合物反应,该反应的化学方程式是 ,该反应属于 反应。
能和浓硫酸、浓硝酸的混合物反应,该反应的化学方程式是 ,该反应属于 反应。
(3)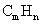 的一氯取代物有 种
的一氯取代物有 种
24.(6分)把煤作为燃料可通过下列两种途径:
途径Ⅰ: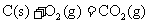
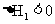 ①
①
途径Ⅱ:先制成水煤气: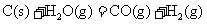
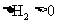 ②
②
再燃烧水煤气: 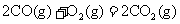
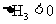 ③
③
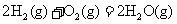
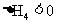 ④
④
请回答下列问题:
(1)途径Ⅰ放出的热量 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)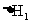 、
、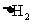 、
、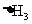 、
、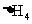 的数学关系式是 。
的数学关系式是 。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com