
11.下列说法正确的是 ( )
A.pH=3的HX与pH=11的YOH等体积混合,所得溶液的pH一定为7
B.在0.1mol/L (NH4)2Fe(SO3)2溶液中c(H+)+c(NH+4)+c(Fe2+)=c(OH-)+c(SO2-4)
C.向醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.4mol/L HCl与0.1mol/L NaAlO2等体积混合,所得溶液中
c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
9.下列实验操作及现象与结论对应关系正确的组是 ( )
|
|
实验操作 |
实验现象 |
实验结论 |
|
A |
适量二氧化碳通入氯化钡溶液中 |
产生白色沉淀 |
碳酸的酸性比盐酸弱 |
|
B |
二氧化硫通入溴水中 |
溶液褪色 |
二氧化硫有漂白性 |
|
C |
取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,渠荡、静置 |
溶液分层,下层呈橙红色 |
原无色溶液中一定有溴离子 |
|
D |
淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 |
产生红色沉淀 |
淀粉水解可生成葡萄糖 |
|
A.15g乙烷含极性共价键的数目为3×6.02×1023
B.标准状况下,11.2L臭氧中含氧原子数为6.02×1023
C.常温下,100mL 0.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023
D.一定条件下2mol二氧化硫和1mol氧气混合,反应时转移的电子数为4×6.02×1023
8.亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中生成HclO2而发生分解,分解的化学方程式为5HclO2 = 4ClO2↑+HclO+2H2O,ClO2是广谱消毒剂。下列说法正确的是( )
A.HClO2是有机酸
B.上述反应中,ClO2是还原产物
C.上述反应中,1molHClO2分解转移2 mol电子
D.上述反应中,氧化剂与还原剂物质的量之比1:4
7.下列说法正确的是 ( )
A.二氧化碳分子中存在共价键和分子间作用力
B.甲烷、氨和水都是由极性键结合而成的极性分子
C.同主族不同元素的最高价氧化物,一定具有相同的晶体结构
D.氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点
6.下列药品和装置合理,能完成相应实验的是 ( )

5.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,可用于潜水艇推进器等。制备某种磁流体时,将等物质的量的硫酸亚铁溶液和硫酸铁溶液混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,所得磁流体的黑色粒子直径在5.5mm~3.6mm之间。下列说法正确的是 ( )
A.所得磁流体属于纯净物 B.油酸钠既含有亲水基又含有增水基
C.油酸钠化学式为C13H35COONa D.所得磁流体的黑色粒子为氧化亚铁
28.(15分)钙是人体神经、骨骼系统等功能正常运作所必须的常量元素。某药业生产的钙片包装上有如下说明:
|
性状 |
本品为白色片 |
|
贮藏 |
密封、干燥处保存 |
|
规格 |
每片含碳酸钙0.5g(相当于钙0.2g) |
|
包装 |
固体药用塑料瓶包装,每瓶100片 |
|
生产批号 |
|
|
生产日期 |
|
|
有效期至 |
|
某学习小组为了确定钙片中碳酸钙的含量符合包装说明上的规格,进行如下实验:
①取一片钙片研碎后加入足量稀盐酸,充分反应后过滤并洗涤。
②取①中滤液加入足量的(NH4)2C2O4溶液,使Ca2+全部转化为CaC2O4沉淀,过滤并洗涤。
③取②中沉淀完全溶于强酸中,得到草酸(H2C3O4),并稀释成1.000L溶液
④取③中溶液20.00mL用0.0050mol/L酸性高锰酸钾溶液滴定,恰好完全反应时,消耗了12.00mL酸性高锰酸钾溶液,反应的离子方程式是(未配平)
MnO4-+ H2C2O4+ H+- MnO2++ CO2↑+ H2O
(1)配平该反应的离子方程式(将化学计量数填于空白处)。
(2)过滤操作中需要用到的玻璃仪器的名称是 。
(3)简述步骤②中沉淀是否洗涤干净的方法(写出操作、现象和结论): 。
(4)滴定时是否需要指示例? (填“是”或“否”),理由是 。
(5)学习小组根据以上实验,计算出钙片中含碳酸钙的质量是 g/片,与包装说明相比较,分析产生该实验结果可能的原因是 。
27.(14分)A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲物质具有磁性。它们之间有如图所示的转化关系:
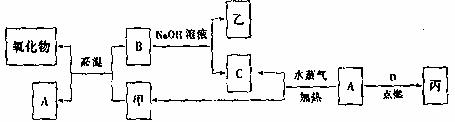
请回答下列问题:
(1)B与甲反应的化学方程式是 。
B与NaOH溶液反应的离子方程式是 。
(2)含有B形成的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。
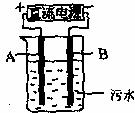
(4)电浮选凝聚法是工业上采用的一种污水处理方法,下图是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体污物带到水面形成浮渣而刮去,起到浮选净作用;阳极产生的沉淀具有吸附性,吸附污物面沉积,起到凝聚净化作用。阳极的电极反应分别是 、
2H2O-4e-=4H++O2↑;阳极区生成沉淀的离子方程式是 。
26.(15分)短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1:1的离子化合物A,X与Z能形成原子个数比为1:1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
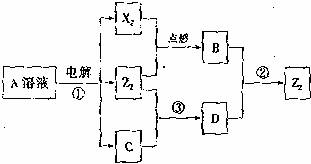
(1)Y在周期表的位置是 ; Z2的电子式是 。
(2)反应①的化学方程式是 。
(3)D溶液呈碱性的原因是(用离子方程式表示) ;D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z3,仪器装置如图所示(夹持固定装置的仪器已略去)。
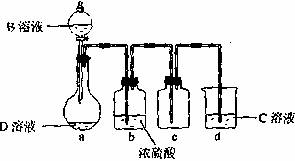
I.反应②的离子方程是 。
II.上述实验装置不够完善,改进方法是 。
(4)Z2跟C在常温时发生的反应③,在加热条件下发生的反应是:
3z2+6C
 5A+YZO3+3H2O,3molZ2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是
。
5A+YZO3+3H2O,3molZ2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是
。
25.(16分)市场上销售的某种洗手液中含有PCMX,对革兰氏阳性和阴性菌及霉菌具有极好的杀灭效果。
(1)PCMX分子中含有苯环,相对分子质量为156.5,该有机物含有碳、氢、氧,氯四种元素,其中氯和氧元素的质量比为35.5:16,则有机物的分子式是 。
(2)PCMX分子的苯环上含有四个取代基,其中相同的两个取代基处于间位,另外两个不同的取代基处于对位;该有机物在一定条件下能跟浓溴水发生苯环上的取代反应,且PCMX与Br2的物质的量之比为1:2。PCMX的结构简式是 ,其中含氧官能团的名称是 。
(3)PCMX在光照的条件下,跟氧气反应生成一氯化物的化学方程式是 。
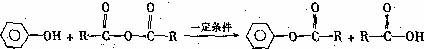
(4)已知 ,
PCXM与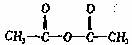 反应的化学方程式是 。
反应的化学方程式是 。
(5)PCMX的同分异构体中,有两个取代基,且能跟FeCl3溶液发生显色反应的有 种,写出其中两种的结构简式 , 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com