
25.(6分)在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol· L-1, c(OH-)=10-bmol·L-1,
已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW= ;
(2)b= ,原Ba(OH)2稀溶液的物质的量浓度为 ;
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大值,若原硫酸与硫酸钠混合溶液的PH为4,则其中硫酸钠的物质的量浓度为 。
24.(9分)已知某无色透明溶液中仅含有包括Na+和CH3COO-在内的四种离子。请回答下列问题:
(1)该溶液中的溶质可能有三种情况。分别为(填化学式)
① ,② , ③ ;
(2)当该溶液中溶质为两种,且溶液呈碱性时,四种离子的物质的量浓度由大到小的排列顺序可能为(可能有多种情况,只写出两种即可):
① ,
② ;
(3)当溶液中各离子浓度大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),该溶液可能是 (填序号)。
A. 由0.1mol·L-1的CH3COOH溶液与0.1mol·L-1的NaOH溶液等体积混合而成
B. 由0.1mol·L-1的CH3COONa溶液与0.1mol·L-1的NaOH溶液等体积混合而成
C. 由0.1mol·L-1的CH3COONa溶液与0.1mol·L-1的CH3COOH溶液等体积混合而成
23.(7分)氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请你解答下列各题:
(1)用氢气和氮气合成氨是一个可逆反应,化学方程式为:N2(g)+3H2(g) 2NH3(g)。已知,在常温下,1gH2完全转化为NH3,放出的热量为15.4kJ;
2NH3(g)。已知,在常温下,1gH2完全转化为NH3,放出的热量为15.4kJ;
①写出该反应的热化学方程式 。常温下,将10mol N2和30mol H2放入合成塔中,放出的热量 (填“等于”、“大于”或“小于”)924kJ;
②已知该反应的ΔS=-198.2J·mol-1·K-1。请判断上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
(2)Marnellos和Stoukides发明了电化学制备氨气的方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传递H+,这种方法实现了高温常压下高转化率的电化学合成氨。已知阳极发生的电极反应为:H2→2H++2e-。则阴极的电极反应式为 。
22.(6分)镉可用于镍镉电池的制作,也是生产颜料的原料,另外镉的化合物在PVG稳定剂、发光材料、半导体材料、杀菌剂等方面都有着广泛的应用。在元素周期表中,镉与锌同族,而锌和汞在自然界中往往共生,这三种金属的活动性顺序:锌>镉>汞。工业上湿法炼锌过程产生的渣泥中含有Cu、Cd、Zn等多种金属,所以可以用这种“渣泥”生产镉。
用炼锌的“渣泥”生产镉的工艺流程如图所示:
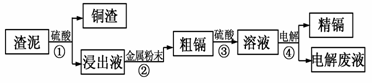
请根据框图回答下列问题:
(1)写出锌(30Zn)在元素周期表中的位置:第 周期ⅡB族;
(2)写出步骤①中镉参加反应的离子方程式 ;
(3)步骤②所加入金属的名称是 ;
(4)步骤④中镉在阴极析出,用镉板作为该电极材料,该电极的反应式是 ;
(5)“电解废液”中含有镉元素,不能直接排放。目前含镉的废水处理的方法之一是在含镉污水中加入硫化钠,沉淀镉离子。写出该反应的离子方程式 。
21.(6分)下列实验操作或对实验事实的叙述正确的是 (填序号)。
①用碱式滴定管量取20.00mL 0.10mol·L-1KMnO4溶液
②用托盘天平称取12.58g干燥的NaOH固体时,各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
③将干燥的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH
④中和滴定中,锥形瓶用蒸馏水洗净后直接往其中注入一定量的待测溶液
⑤把铁钉和碳棒用导线相连浸入食盐水中,碳棒上放出氯气
⑥用吸收了CO2的固体NaOH配制的标准溶液去测定未知浓度的盐酸,测定结果偏低
⑦配制氯化亚锡溶液时,需加少量盐酸
⑧铁件上镀银时,应将银电极与直流电源的正极相连,用AgNO3溶液作电镀液
20. 为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体
③在②实验后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀
④取③实验后的上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验判断,以下推测正确的是
A. 一定有SO32-离子 B. 一定有HCO3-离子
C. 不能确定CO32-离子是否存在 D. 不能确定Cl-离子是否存在
第Ⅱ卷(非选择题 共50分)
19. 已知反应CaCO3(s)===CaO(s)+CO2(g)的有关数据如下:ΔH=178.2kJ·mol-1, ΔS=169.6J·mol-1·K-1则欲使碳酸钙分解为氧化钙和二氧化碳的反应自发进行,所需的温度不应该低于(假设该反应的焓变和熵变不随温度变化而变化)
A. 800K B. 298K C. 1051K D. 1K
18. 如下图所示,下列叙述正确的是
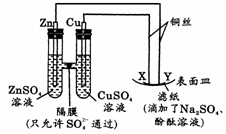
A. Y为阴极,发生还原反应
B. X为正极,发生氧化反应
C. Y与滤纸接触处变红
D. X与滤纸接触处有氢气生成
17. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,ClO-把Ni2+氧化生成Ni2O3。以下说法正确的是
A. ClO-把Ni2+氧化生成Ni2O3时反应的离子方程式是:
ClO-+2Ni2++4OH-=Ni2O3+Cl-+2H2O
B. 可用铁作阳极材料
C. 电解过程中阳极附近溶液的pH升高
D. 每生成1molNi2O3,外电路中转移1mol电子
16. 已知反应①H2(g)+ 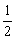 O2(g)===H2O(g) ΔH1
O2(g)===H2O(g) ΔH1
②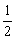 N2(g)+O2(g)===NO2(g) ΔH2
N2(g)+O2(g)===NO2(g) ΔH2
③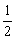 N2(g)+
N2(g)+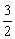 H2(g)===NH3(g) ΔH3
H2(g)===NH3(g) ΔH3
那么在相同温度下反应:4NH3(g)+7O2(g)===4NO2(g)+6H2O(g)的反应焓变为
A. 4ΔH3-6ΔH1-4ΔH2 B. 6ΔH1+4ΔH2-4ΔH3
C. ΔH1+ΔH2-ΔH3 D. ΔH3-ΔH1-ΔH2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com