
(一)[猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]: (“填猜想I成立”或“填猜想I不成立”);
21.(10分) A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,B是最活泼的非金属元素,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是最强的含氧酸之一。
(1)B在周期表中的位置:第 周期、第 族,E的元素符号为_______ ;
(2)物质乙可用于潜艇或航天飞机作供氧剂,写出乙与CO2反应的化学方程式:
____________________________ ;
(3)单质D与C的最高价氧化物对应水化物溶液反应的离子方程式:
______________________________________________________________________ ;
(4)1 mol 单质B的气体与1 mol C的氢氧化物在一定条件下恰好完全反应,生成一种盐、水及另一种气体,则所得气体的化学式为:__________________________ 。
22.(10分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
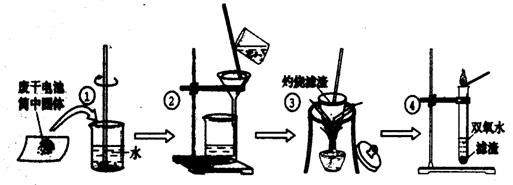
(1) 操作②中过滤时玻璃棒的作用: ;
(2) 操作④加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式: ;
(3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为: 。
(4) 已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
20.中科大陈乾旺教授等人发明RTX-r_合成金刚石的新方法,化学原理为:
① Na+CO2
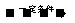 C(金刚石)+C(石墨)+Na2CO3(未配平);
C(金刚石)+C(石墨)+Na2CO3(未配平);
该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:
以下表述中正确的是
A.反应①中既有旧化学键的断裂又有新化学键的形成
B.新方法利用的是化学变化,旧方法利用的是物理变化
C.在反应①中每生成12g金刚石需要消耗23g金属钠
D.反应①和反应②中所得的金刚石都是还原产物
19.常温时,0.1mol/LHA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/ c(H+)=1012 ,将这两种溶液等体积混合,以下离子浓度关系判断正确的是
A.c(H+)<c(OH-)<c(A-)<c(B+)
B.c(OH-)<c(H+)<c(B+)<c(A-)
C.c(A-)= c(B+)>c(H+)=c(OH-)
D.c(H+)+ c(B+)= c(OH-)+ c(A-)
18.下列离子方程式正确的是
A.用石墨作电极电解饱和食盐水:2Cl-+2H2O 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.Fe3O4与过量的稀HNO3反应: Fe3O4+8H+
 Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
C.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.Na2S溶液呈碱性:S2-+2H2O
 H2S+2OH-
H2S+2OH-
17.将1mol H2(g) 和2mol I2(g) 置于某2L密闭容器中,在一定温度下发生反应:
H2(g)+ I2(g) 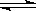 2HI(g) ;△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(II)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g) ;△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(II)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
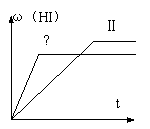

A.恒温恒容条件下,加入适当催化剂 B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度 D.恒温条件下,扩大反应容器体积
16.设阿伏加德罗常数约为NA,下列叙述中正确的是
A.标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数为NA
B.1 mol Fe在过量的 C12中充分燃烧,转移的电子数为2NA
C.0.1mol CH4所含的电子数为NA
D.1 L l mol·L-1的Na2C03溶液中离子总数为3NA
15.铜的冶炼大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2 FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2 ==2Cu2O+2SO2 ; 2Cu2O+ Cu2S==6 Cu+SO2↑;
④电解精炼铜。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排空
B.上述过程中,由6mol CuFeS2制取6molCu时共消耗12 molO2
C.在反应2Cu2O+ Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
D.电解精炼铜时,粗铜应与外接电源的正极相连接
14. 由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是
A. 已经制得了IBr、ICl等卤素互化物
B. 已经制得了I2O5等碘的氧化物
C. 已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+离子的离子化合物
D. 碘单质(I2)在通常情况下为具有金属光泽的紫黑色固体
13.石墨与金刚石都是碳的单质,工业上常用石墨在一定条件下转化为金刚石的反应原理生产人造钻石。已知12g石墨完全转化成金刚石时需要吸收E kJ的能量。则下列说法正确的是
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
D.等质量的石墨和金刚石完全燃烧,石墨放出的能量多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com