
1.下列物质中,不含有硅酸盐的是
A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
27.(10分) 下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
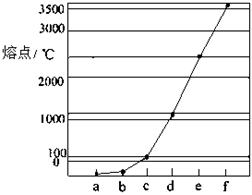
(1)请写出上图中d单质对应元素原子基态时的电子排布式 。
(2)单质a、f、b对应的元素以原子个数比1:1:1 形成的分子中含 个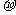 键, 个
键, 个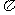 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为 ,其中X与d的高价离子之间以 键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为: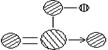 该含氧酸的分子式为:
,请简要说明该物质易溶于水的原因
该含氧酸的分子式为:
,请简要说明该物质易溶于水的原因
《有机化学基础》模块试题(10分)
26. (10分)有机粘合剂的粘合过程是液态的小分子粘合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α-氰基丙烯酸乙酯(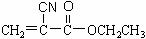 ),请写出“502胶”发生粘合作用的化学方程式: ;反应类型是
),请写出“502胶”发生粘合作用的化学方程式: ;反应类型是
。
(2)厌氧胶( )也是一种粘合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂,该物质的名称是
;请写出这一制取过程的化学方程式:
。
)也是一种粘合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂,该物质的名称是
;请写出这一制取过程的化学方程式:
。
(3)白乳胶是常用的粘合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如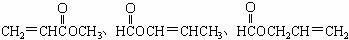 。已知含有
。已知含有
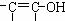 结构的物质不能稳定存在。请另外写出3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
。
结构的物质不能稳定存在。请另外写出3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
。
(4)已知醇和醛可以发生反应:
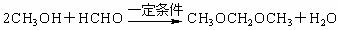 ,聚乙烯醇
,聚乙烯醇 可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
。
可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
。
《物质结构与性质》模块试题(10分)
25.(10分) 研究表明,火灾中绝大多数人的第一死因并非高温烘烤或火烧,而是慌乱奔跑时吸入烟雾中毒。聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:
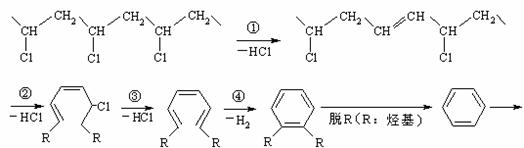
请回答下列问题:
(1)火灾中由聚氯乙烯产生的有害气体,其化学成分主要是 ,你认为其中含量最大的为 ,在火灾现场为防止气体中毒的防护措施是 。
(2)工业上用乙烯和氯气为原料经下列各步合成聚氯乙烯(PVC)。
乙烯 甲
甲 乙
乙 PVC
PVC
乙是PVC的单体,其结构简式为 ,反应①、③的化学方程式分别为: 、 。
(3)聚氯乙烯可以制成保鲜膜,化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐( 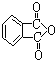 )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:
。
24.(9分)
向体积为2 L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g) 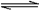 Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min 后反应达到平衡 , 此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为 mol/(L·min)。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5 mol/(L·min);乙:v(Y)=2 mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)=0.075 mol/(L·s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氮气,则平衡向 (填"左"或"右"或"不)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填“左”或“右”或“不”)移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则平衡后X 的转化率与(1)的平衡中X的转化率相比较:
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为 。
(6)若保持温度和体积不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
23.(15分)(I)(6分) 已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,
且Ksp(AgX)= 1.8×10-10,Ksp(AgY)= 1.0×10-12,Ksp(AgZ)= 8.7×10-17。
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为: 。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为 。
(4)由上述Ksp判断,在上述(3)的体系中, (填“能”或“否”)实现AgY向AgZ的转化,并简述理由: 。
(II)(9分)“嫦娥一号”成功发射,实现了中国人“奔月”梦想。
(1)发射“嫦娥一号”的长征三号甲火箭的第三级使用的推进剂是液氢和液氧,下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:
H2(g)+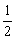 O2(g)== H2O(l)
△H =-285.8kJ/mol
O2(g)== H2O(l)
△H =-285.8kJ/mol
C(s)+O2(g)== CO2(g) △H=-393.5kJ/mol
C8H18(l)+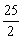 O2(g)== 8CO2(g)+ 9H2O(l) △H=-5518kJ/mol
O2(g)== 8CO2(g)+ 9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)== CO2(g)+ 2H2O(l) △H=-890.3kJ/mol
通过计算说明等质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是 ,发射“嫦娥一号”的长征三号甲火箭的第三级使用液氢和液氧这种推进剂的优点是
; (请写两条) 。
(2)已知:H2(g)== H2(l); △H=-0.92kJ/mol
O2(g)== O2(l); △H=-6.84kJ/mol
H2O(l)== H2O(g); △H=44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式: 。如果此次发射“嫦娥一号”的长征三号甲火箭所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,总共释放能量 kJ(保留3位有效数字)。
(3)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:负极: ; 正极: ;总反应式: 。
22.(11分) 气体混合物中各组分所占比例常用该气体的分压表示,下图是SO2在水中溶解度与SO2分压关系图。

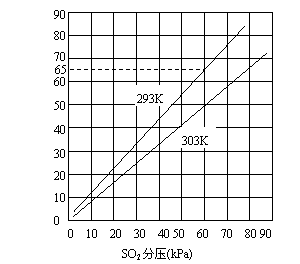

(1) 上图反映SO2气体在水中溶解度大小与哪些因素有关 ,
这些因素如何影响SO2气体的溶解度 。
(2) 二氧化硫是污染大气的主要有害物质之一。除去SO2的方法有多种,其中有一种方法叫“石灰石脱硫”法,原料为石灰石,产品为石膏。请写出相关的化学方程式 。
(3) 一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为:
2C8H18+23O2 12CO2+4CO+18H2O
12CO2+4CO+18H2O
①某环境监测兴趣小组的同学描绘某市市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是( )
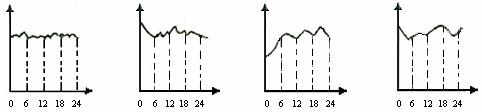
A B C D
②为了解决机动车污染空气的问题,你有何建议?(提2条)
。
21.(14分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
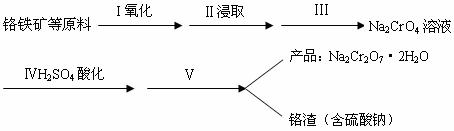
①步骤I中反应的化学方程式为:
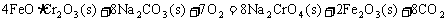
该反应的化学平衡常数的表达式为 ,在常温下该反应速度极慢,下列措施中不能使反应速率增大的是 。
A.升高温度 B.将原料粉碎
C.增加纯碱的用量 D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体。 |
20.(9分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
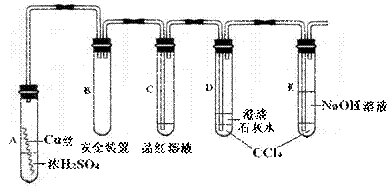
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录。
|

根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CCl4的作用是
。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是: 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 (写化学式)。
19.(9分)以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
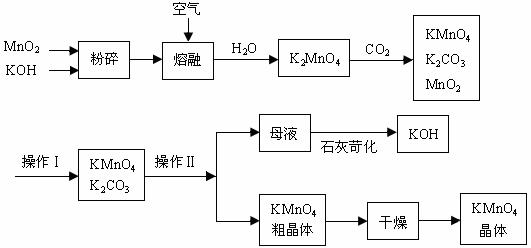
(1)操作I的实验操作名称是 。
(2)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(3)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
A.84消毒液(NaClO溶液) B.双氧水 C.甲醛 D.75%酒精
(4)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
A.浓硝酸 B.硝酸银 C.新制氯水 D.烧碱
(5)该生产中需要纯净的CO2气体。若实验室要制备少量纯净的CO2所需试剂最好选择___ __(选填代号)。
A.石灰石 B.稀HCl C.稀H2SO4 D.纯碱
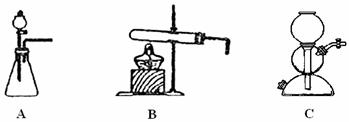
所需气体发生装置是_____________(选填代号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com