
24.(11分)氯碱工业中,通过电解饱和食盐水获得重要的化工原料,其产物中的氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、聚氯乙烯、氯苯等。
(1)电解食盐水的离子方程式为 。氯气用于生产半导体材料硅的流程如下:


①石英砂的主要成分的化学式为 ,在制备粗硅时,焦炭的作用是 。
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯。其提纯方法为 。
③由四氯化硅得到高纯硅的化学方程式为: 。
(2)用于制造塑料薄膜、人造革、塑料管材和板材的聚氯乙烯(PVC塑料)就是以氯气和乙烯为主要原料通过 、消去和 三步主要反应生产的,这三步的化学方程式分别为: 、CH2Cl-CH2Cl
 CH2
=CHCl +HCl、
。
CH2
=CHCl +HCl、
。
(3)上述两种生产过程可得到同一种副产品,该副产品是 。
23.(10分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是确定的致癌、致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。某同学设计测定甲醛的方法如下(假设空气中无其它还原性气体):
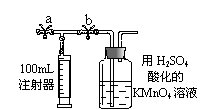

(1) 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,化学反应离子方程式为:4MnO4-+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4-+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
(2)测定装置:部分装置如图所示(a、b为止水夹)
(3)实验步骤:
①用 (填仪器名称)准确移取25.00 mL 1.00×10-3mol·L-1的KMnO4溶液(过量)于广口瓶中并滴入3滴6mol·L-1H2SO4溶液备用;
②将2.00×10-3mol·L-1的草酸标准溶液置于 (填仪器名称)中备用;
③于装修完工后的第30天取样:打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生的不利后果是____________ _____;
④将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2-3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将 (填“偏高”、“偏低”、“无影响”);
⑤用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。本实验
(填:需要、不需要)指示剂。
⑥再重复实验2次。
(4)数据处理:设 KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为V1(mL);草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为V2(mL)则:计算室内空气中甲醛浓度(mg/m3)的代数式为 (用c1、c2 、V1、 V2表示);
照上述方法实验平均消耗草酸30.79mL。计算第30天室内空气中甲醛浓度为_____________ mg/m3(精确到小数点后二位),并判断此时主人________(填:能或不能)入住。
22.(11分)已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲 (实验中使用的过滤强酸性液体的是耐酸过滤器) 。完成由上述混合物得到固体甲的实验设计,请填写下表中空格:
|
序号 |
实验步骤 |
简述实验操作 (不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加入98%H2SO4,充分搅拌直到固体不再溶解 |
|
② |
|
安装好过滤装置,
|
|
③ |
|
在另一烧中放入适量蒸馏水,
|
|
④ |
再过滤 |
重新安装过滤装置,
|
|
⑤ |
|
,等水滤出后,再次加水洗涤,连洗几次 |
|
⑥ |
检验沉淀 是否洗净 |
,如果没有白色沉淀,说明沉淀已洗净 |
21. (8分)学习了元素周期表后,同学们对第四周期过渡元素产生了浓厚的兴趣。是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用效率怎样?请你与他们一起进行实验探究:
I 课题名称:____________________________________________________________。
II实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、大试管、 、 等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略 IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算为标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:(1)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)。
(2)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是____________ _______________________。
VI 实验结论:_____________________________________________________________
20.几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
K |
L |
M |
Q |
R |
T |
N |
|
原子半径/nm |
0.183 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
+1 |
下列叙述正确的是
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
19.常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是
A. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
C. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D. pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
18.符合下列各种条件的溶液中,各组离子可能大量共存的是
A.滴加石蕊试液呈红色的溶液:K+、SO42-、NO3-、NH4+
B.250C,pH=0的溶液中:Al3+、NH4+、NO3-、Fe2+
C.加入铝粉后能产生气体的溶液中:Cu2+、Ba2+、Cl-、NO3-
D.水电离出来的c(OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ca2+
17.下列有关反应热的叙述正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.C(s,石墨)=C(s,金刚石);△H=+1.9kJ·mol-1,说明金刚石比石墨稳定
 C.X(g)+Y(g) Z(g)+W(s);△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
C.X(g)+Y(g) Z(g)+W(s);△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
D.已知C(s)+O2(g)=CO2(g);△H1 , C(s)+1/2O2(g)=CO(g);△H2,则△H1<△H2
16.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质的浓度如下表。据此下列结论正确的是
|
测定时刻/s |
t1 |
t2 |
t3 |
t4 |
|
c(A) / (mol·L-1) |
6 |
3 |
2 |
2 |
|
c(B) / (mol·L-1) |
5 |
3.5 |
3 |
3 |
|
c(C) / (mol·L-1) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:
2A + B C
C
D.在t2~t3内A的平均反应速率为 [1/(t3-t2)]mol/L·s
15.下列相对应的离子方程式错误的是
A.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
B.
用醋酸除去水垢中的碳酸盐: 2CH3COOH+CO32- 2CH3COO-+H2O+CO2↑
2CH3COO-+H2O+CO2↑
C. 氯化铵溶液中滴入烧碱稀溶液: NH4++OH-===NH3·H2O
D.NaHSO4溶液中滴加NaHCO3溶液:H+ + HCO3- == H2O + CO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com