
5.下列情况会对人体健康造成较大危害的是
A.自来水中通入少量Cl2进行消毒杀菌
B.用小苏打(NaHCO3)发酵面团制作馒头
C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D.用SO2漂白食品
3.在实验室中,对下列事故或药品的处理正确的是
A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B.金属钠、钾着火燃烧时,迅速用水灭火
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D.酒精灯着火时,马上用水浇灭
2.下列含硅物质的用途错误的是
A.硅是制造太阳能电池的常用材料 B.二氧化硅是制造光导纤维的材料
C.水玻璃可用作木材防火剂 D.纯碱、生石灰和硅是制取玻璃的原料
1.下列物质的分类正确的是
A.纯碱、烧碱均属于碱 B.SiO2、SO2均属于酸性氧化物
C.凡能电离出H+的化合物均属于酸 D.焰色反应呈黄色的均属于钠盐
29. (10分)水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
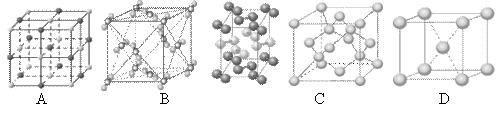
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)

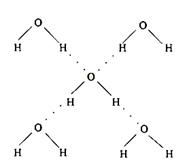
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(7)分析下表数据,请写出你出的最具概括性的结论:
① ;
② 。
|
键型 |
键能 (kJ/mol) |
键长 (pm) |
分子 |
键角 |
物质 |
熔点(℃) |
沸点(℃) |
|
H-C |
413 |
109 |
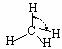 |
109.5º |
甲烷 |
-183.7 |
-128.0 |
|
H-N |
393 |
101 |
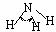 |
107 º |
氨 |
-77.7 |
-33.3 |
|
H-O |
463 |
96 |
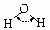 |
104.5 º |
水 |
0.0 |
100.0 |
28.(10分)
卤代烃在NaOH醇溶液、或乙醇钠的醇溶液发生以下反应(并附有关数据):
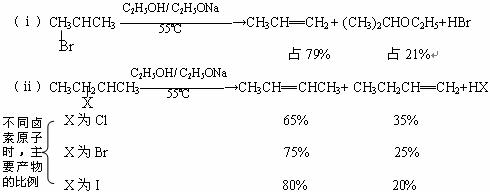
(1)根据上面两个反应的条件及其数据,请写出你认为最具概括性的两条结论:① 。
②
。
(2)由丙烯经下列反应可制得化工原料H及F、G两种高分子化合物(它们都是常用的塑料),其合成线路如下:
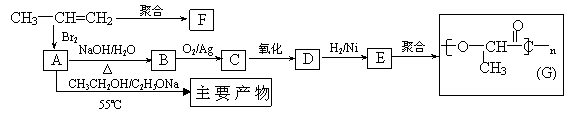
 请完成下列填空:
请完成下列填空:
①写出结构简式:聚合物F是 ,产物H ;
②B转化为C的化学方程式为: ;
③在一定条件下,两分子E能脱去两分子水形成一种元环状化合物,该化合物的结构简式是 。
27. (9分)已知:, 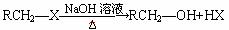
 ,其中-R为烃基。
,其中-R为烃基。
利用“惕各酸”[CH3CH==C(CH3)COOH]可以合成广泛用于香精的调香剂“惕各酸苯乙酯”(分子式为C13H16O2),某实验室的科技人员设计了如下合成路线:

请回答下列问题:
(1)上述各步反应中,原子利用率为100%的是 (填序号)。
(2)试写出:A的结构简式 ;C的结构简式 。
(3)化合物H不能发生的反应是 (填字母序号):
(a)加成反应、(b)取代反应、(c)置换反应、(d)酯化反应、(e)水解反应、
(f)加聚反应
(4)试写出反应⑥的反应方程式: 。
26.(10分)在某个容积为2.0 L的密闭容器内,在T℃时按下图1所示发生反应:
mA(g)+nB(g) pD(g)+qE(s),DH<0(m、n、p、q为最简整数比)。
pD(g)+qE(s),DH<0(m、n、p、q为最简整数比)。
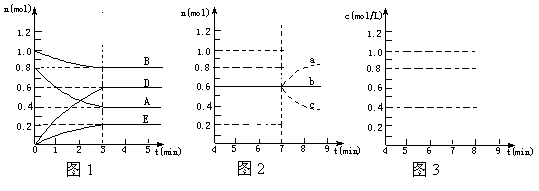

(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为____ _;
(2)该反应的化学平衡常数K的数值为_________________(保留至两位小数);
(3)反应达到平衡后,第7 min时:
①若降低温度,D的浓度变化最可能的是_____(用图2中a~c的编号回答);
②若在7min时仍为原平衡,此时将容器的容积压缩为原来一半,请在图3中画出7 min后D浓度变化情况。
(4)在T℃时,相同容器中,若开始时加入0.2 mol A 、0.8 mol B 、0.9 mol D 、0.5 mol E反应,达到平衡后,A的浓度范围为_______________________。
(5)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
25.(11分)亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见下图)。利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用与化学的定性或定量研究。
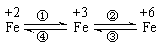
已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水中不稳定:
4FeO42-+2OH+ ==4Fe3+ + 3O2 ↑+10 H2O;4FeO42-+10 H2O== 4Fe(OH)3 ↓+3O2↑ +8 OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH溶液、NaClO溶液、盐酸、氯水、蒸馏水及必要的实验仪器。完成下列任务:
(1)设计一个实现上述转化①(由FeCl2溶液制FeCl3固体)或④(由FeCl3溶液制FeCl2固体)的实验方案(要求产物纯净),你选择 (填:①或④),其简要实验步骤为:
。
(2)在浓碱中,用NaClO可以实现转化②,请完成这一反应的离子方程式:
3ClO-+ 2Fe(OH)3+ = 2FeO42-+ +5H2O
(3)一种新型高能碱性电池利用了转化③将化学能转化为电能。该电池由电解质(KOH水溶液)、K2FeO4、金属锌及必要的填充材料构成。请完成该电池放电时发生反应的化学方程式:2K2FeO4 + + 8H2O == 2Fe(OH)3 + 3Zn (OH)2 + 。
(4)高铁酸盐是比高锰酸盐更强的氧化剂,它还是一种“绿色、环保、高效” 净水剂,具有很好的杀菌效果、形成絮凝物将水中的悬浮杂质除去。说它是“绿色环保高效” 净水剂的原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com