
7.某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是 ( )
A.溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
B.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
C.若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
D.若溶液中c(A-)== c(Na+),则溶液一定呈中性
6.把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是 ( )
A.SO2 B.Cl - C.Fe3+ D.NO3 -
29.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:1。
请回答:
(1) 组成A分子的原子的核外电子排布式是 ;
(2) B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液现象是 ,该反应的化学方程式为
(4)若将1molE在氧气中完全燃烧,只生成1molCO2和2molH2O,则E的分子式是 。
28.某有机化合物A的结构简式如下:

(1)A分子式是 。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是
B: C:
该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
①浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3 ④Na⑤ CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的同分异构体的结构简式(写出其中的两种)。
①化合物是1,3,5-三取代苯
②苯环上的三个取代基分别为甲基、羟基和含有?C=O?结构的基团。
27.“C1化学”是指以分子中只含一个碳原子的物质为原料进行物质合成的化学。下图是以天然气的主要成分为原料的合成路线流程图,其中“混合气体”的成分与水煤气相同;B的水溶液有杀菌防腐性能;D是C的钠盐,2mol D分子间脱去1mol H2分子可缩合生成E;H是F与A按物质的量之比为1∶2反应的产物。

填写下列空白:
(1)天然气主要成分的电子式是 ;E的化学式是 。
(2)D、G的结构简式是D G 。
(3)写出下列反应式的化学方程:
A→B
A+F→H 。
26. (11分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:

若E和F均为有刺激性气味的气体,H不溶于酸,请填写下列空白。
(1)气体E的化学式为 ,气体F的化学式为 ,C中溶质的化学式为 。
(2)写出下列反应的离子方程式:
C→E ;
D+G→H ;
(3)在混合溶液G中滴人几滴石蕊溶液,可见现象为 ,
原因是 。
25.(8分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA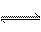 H++A-,则K==式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A-,则K==式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1==4.31×10-7 K2==5.61×10-11 |
|
H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1==9.1×10-8 K2==1.1×10-12 |
|
H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- |
K1==7.52×10-3 K2==6.23×10-8 K3==2.20×10-13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_____________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是___________________________________。
24.(14分)某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
方案甲:

方案乙:

(1)两个方案哪个符合当前生产的绿色理念,为什么?
;
(2)写出方案甲中的②③步骤反应的离子方程式:
;
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简便方法检验红色粉末中是否含有过量的铁屑 如果有,请你提出合理的处理方案
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、 、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
23.(10分)石灰石的主要成份是碳酸钙,含氧化钙约 40~50% ,较好的石灰石含 CaO 约 45~53% 。此外还有 SiO2 、 Fe2O3 、 Al2O3 及 MgO 等杂质。测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC2O4·H2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量。 涉及的化学反应为:
H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)
CaC2O4 沉淀颗粒细小,易沾污,难于过滤。为了得到纯净而粗大的结晶,通常在含 Ca2+的酸性溶液中加入饱和 (NH4)2C2O4 ,由于 C2O42- 浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中 C2O42- 浓度慢慢增大,可以获得颗粒比较粗大的 CaC2O4 沉淀。沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使 CaC2O4 溶解度太大。
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
(4)写出硫酸溶解草酸钙沉淀的离子方程式:
(5)若开始用去m g样品,最后滴定用去浓度为C mol/L 的KMnO4 溶液 v ml,推出CaO含量与 KMnO4的定量计算关系。ω%=
22.(12分) I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
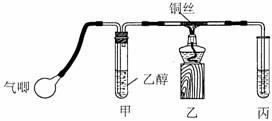
⑴实验时,常常将甲装置浸在70℃-80℃的水浴中,目的是① ____;由于装置设计上的缺陷,实验进行时可能会 ②_____ _______
⑵反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因:③ ;你认为该实验中“鼓气速度”这一变量可用④ 来计量

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com