
29.(18分)根据下图回答问题:
(1)装置气密性的检验须在盛放药品前进行。在上述装置中,往试管B、C、D中各加入5 mL蒸馏水封住导管口,各连接处都紧密而不漏气的情况下,点燃酒精灯,微热带支管的试管一会儿,试管B、C、D中未出现气泡;熄灭酒精灯后,试管B、C、D中导管内水面也未上升,其原因是: 。

(2)①一般来说,硫酸的质量分数大于60%,就具有一定的氧化性,且越浓氧化性越强;
②温度也要影响氧化性,如铜放于冷的浓硫酸中反应不明显,加热就可观察到明显现象。
同学利用上述装置,用实验来验证硫酸氧化性的上述结论(已知98%的浓硫酸的密度为1.84g·cm-3)。他先向试管B加入5mL晶红试液,向试管C、D中各加入5mL饱和澄清石灰水;向带支管的试管中放人铜粉和3mL水,然后从分液漏斗向支管试管中滴加98%的浓硫酸10滴(约0.5 mL),加热至沸腾,这时支管试管中溶液颜色是否有明显变化 (填“无”或“有”),试用数据解释其原因 ;该同学用分液漏斗再向支管试管中加98%的浓硫酸l0 mL,并加热至沸腾,观察到的现象分别是:支管试管中 ,B试管中 。
(3)乙同学利用上述装置来检验浓硫酸和木炭粉在加热条件下发生反应的全部产物。
①浓硫酸和木炭粉在加热条件下发生反应的化学方程式为:
②要达此目的,则:
A中加入试剂的名称是 ,作用是 ;
B中加入试剂的名称是 ,作用是 ;
C中加入试剂的名称是 ,作用是 ;
D中加入试剂的名称是 ,作用是 。
28.(16分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
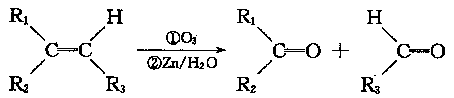
已知:有机物A的相对分子质量为134;经分析得知,其中氢和氧的质量分数之和为19.4%,其余为碳。有机物A、E中均含有苯环结构,且苯环上的一溴代物只有两种,它们都能与FeCl3溶液发生显色反应;有机物C能发生银镜反应。下图表示有机物A-H的转化关系。

请回答下列问题:
(1)化合物A中含有的碳原子数为 ,该化合物的分子式是 。
(2)写出下列化合物的结构简式:A ,C ,E 。
(3)写出由F发生臭氧化还原水解反应生成G的化学反应式(有机物写结构简式):
(4)化合物H(C7H6O2)的含有苯环且侧链无其它环的所有同分异构体共有 种。
27.(12分)四种短周期元素A、B、C、D,它们原子的电子层数与最外层电子数之比分别是l:1/3,l:l,1:2和l:3。
据此回答下列问题:
(1)仅根据上述信息就能够确定的元素是 (选填A、B、C、D)。
(2)在所有满足上述信息的短周期元素中,最高价氧化物的水化物酸性最强的是(填化学式) ;由A、D两元素构成的化合物A2D2的电子式为(用元素符号填写,下同) 。
(3)写出所有满足上述信息的化合物CD2与化合物A2D2反应的化学方程式:
(4)在满足上述信息的短周期元素中,若B2、CD和由B、C、D形成的化合物X的混合物mg,在一定条件下与过量氧气充分反应后,将产物通过足量的固体A2D2,最终发现固体质量增重为mg,则符合此条件的X的分子组成可用通式( )x·( )y来表示。
26.(14分)粉末状样品A是由等物质的量的MgO和A12O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。
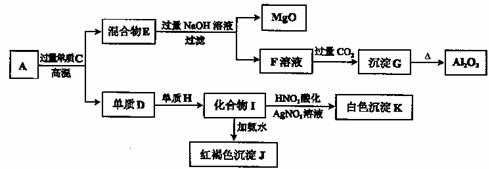
请回答下列问题:
(1)单质C和H的化学式分别是 、 。
(2)写出由I生成J的离子方程式: 。
(3)写出由F生成G的离子方程式: 。
(4)若10.7g样品A中MgO、A1203和B的物质的量均为0.05 mol,则B的化学式为 。
(5)若B中金属原子与氧原子的粒子数之比为2:3,取7.10 g样品A,恰好与含xmolHCl的盐酸完全反应,则x的取值范围是 (保留小数点后两位)。
13.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )

A 2 mol Br2 2 mol NaOH B 2 mol Br2 3 mol NaOH
C 3 mol Br2 4 mol NaOH D 4 mol Br2 4 mol NaOH
第Ⅱ卷(非选择题,共174分)
12.下列各组离子,在指定的环境中,能大量共存的是 ( )
A.
B.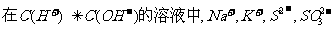
C.在中性溶液中,
D.在酸性溶液中,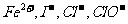
11.已知热化学方程式2SO2(g)+ O2(g) 2
SO3(g) ;△H= -Q kJ/mol(Q>0),则下列说法正确的是 ( )
2
SO3(g) ;△H= -Q kJ/mol(Q>0),则下列说法正确的是 ( )
A.2molSO2(g)和1mol O2(g)所具有的能量大于2 molSO3(g)所具有的能量
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量
C.升高温度,平衡向逆反应移动,上述热化学方程式中的Q值将减小
D.如将一定量SO2(g)和 O2(g)置于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被还原
10.下列有关阿伏加德罗常数的叙述正确的是 ( )
A.0.1mol碳酸钠溶于水所得溶液中所含阴离子数小于6.02×1022个
B.通常状况下,0.5×6.02×1023个甲醛分子所占体积大于11.2L
C.足量锌与一定量浓H2SO4充分反应,放出4.48L气体,转移电子数为0.4NA个
D.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
9.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )
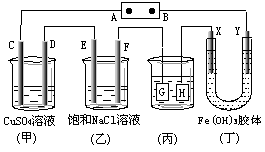
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质 生成,其物质的量比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
8.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
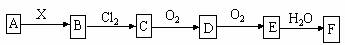
下列说法中不正确的是 ( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com