
20.已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是
A.25℃时,0.1 mol·L-1HF溶液中pH=1 B.KSP(CaF2)随温度和浓度的变化而变化
C.该体系中KSP(CaF2)=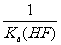 D.该体系中有CaF2沉淀产生
D.该体系中有CaF2沉淀产生
19.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的
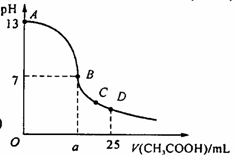
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
18.下列实验方案合理的是
A.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
B.测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放人锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定
C.用分液漏斗分离苯与硝基苯
D.除去氯化铁酸性溶液中的氯化亚铁:加入适量的过氧化氢水溶液
17.如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是
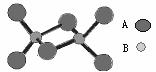
A.该化合物的化学式是Al2Cl6
B.该化合物是离子化合物,在熔融状态下能导电
C.该化合物在潮湿空气中不易变质
D.该化合物中不存在离子键,也不含有非极性共价键
16.下列反应的离子方程式正确的是
A.在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
B.电解饱和食盐水: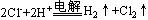
C.过量的铁与浓硝酸反应: Fe+6H++3NO3- = Fe3+ 十3NO2↑+3H2O
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O
15.下列关于反应能量的说法正确的是
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H = -216kJ·mol-1 ,
反应物总能量>生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H = -571. 6 kJ·mol-1 ,H2的燃烧热为571.6 kJ·mol-1
D.H+ (aq) +OH-(aq) =H2O(l) ;△H= -57.3 kJ·mol-1 ,含 1molNaOH 的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
14.元素A和元素B的原子序数都小于18,已知A原子的最外层电子数为a,次外层电子数为b,B原子的M层电子数为(a-b),L层电子数为(a+b),则下列叙述不正确的是( )
A.B元素位于周期表中的第三周期、第IVA族
B.A、B两元素原子通过共价键形成的化合物BA2
C.A、B两元素所形成的化合物能与碳反应
D.A、B两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
13.如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
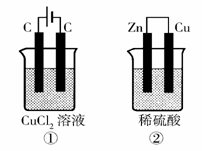
A.产生气体的体积:①>②
B.溶液的pH变化:①减小,②增大
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 2Cl--2e- Cl2 ↑ ②中负极 2H++2e- H2↑
12.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
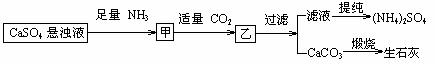
下列推断不合理的是
A.往甲中通适量CO2有利于(NH4)2SO4生成 B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用 D.直接蒸干滤液能得到纯净的(NH4)2SO4
11.2007年据世界卫生组织统计,最常用避孕环是含金属铜的。金属铜的避孕机理之一是:铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com