
6.下列反应的离子方程式正确的是 ( )
A.电解饱和MgCl2溶液:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
B.碳酸氢铵溶液中加入过量氢氧化钠:NH+4+OH-===NH3↑+H2O
C.Na2S溶液呈碱性:S2-+2H2O=== H2S↑+2OH-
D.小苏打溶液中加入过量石灰水:2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O
29.(15分)某有机化合物A的相对分子质量大于150且小于200。经分析得知,化合物中碳、氢、氧的质量比为:7.5:1.125:3。A具有酸性,是蜂王浆中的有效成分,物质的量为0.0002mol的A需用20.0mL 0.0100mol/L氢氧化钠水溶液来滴定达到滴定终点。
(1)有机化合物A的相对分子质量是 ,该化合物的化学式(分子式)是 。
(2)已知A能使溴的四氯化碳溶液褪色,A发生臭氧化还原水解反应生成B和C,B能发生银镜反应,且能与金属钠或氢氧化钠溶液反应。
信息提示:在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
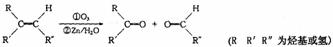
以上反应和B的进一步反应如下图所示。
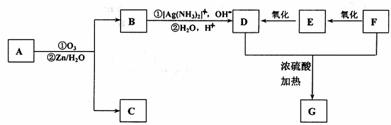
1molD与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况)。若将D与F在浓硫酸作用下加热,可以生成一个化学式(分子式)为C4H4O4的六元环G,该反应的化学方程式是 ,反应类型是 。D与碳酸氢钠反应的化学方程式是 。
(3)经测定,有机化合物C没有支链,分子中没有-CH3。写出有机化合物A的结构简式 。
28.(15分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
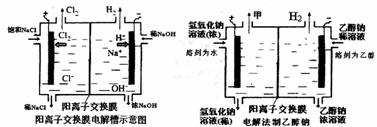
(1)这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
(2)写出在电解过程中发生的电极方程式
阳极: 。
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中发生的电极方程式
阴极: 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇固体的方法是: 。
27.(15分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复):H+、Na+、Al3+、Ag+、Ba2+、OH-、Cl-、CO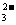 、NO
、NO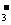 、SO
、SO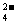
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
④在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解。
试回答下列问题:
(1)A、C的化学式分别为 、 。
(2)A溶液呈酸性的原因 (用离子方程式表示)。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l);△H=-akJ·mol-1(a>0)。请写出C与B的稀溶液反应的热化学方程式 。
(4)在100mL 0.1mol·L-1的E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀的物质的量为 。
26.(15分)有A、B、C、D四种相邻短周期元素(如下图所示),根据元素性质递变规律,回答下列问题:
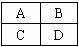
(1)A和C元素;B和D元素各有相似的化学性质,是因为 。
(2)氧与硫处于同一族,性质相似,对应的化合物也有类似的性质,同时有差异,如:H2O与H2S;CH3CH2OH与CH3CH2SH(乙硫醇)等一定相似性。请回答下列问题:
①已知酸性H2O<H2S,试判断乙醇和乙硫醇分别与金属钠反应的剧烈程度
CH3CH2OH CH3CH2SH(填>、<或=)
②CH3CH2Br不仅能与NaOH溶液反应,而且也能与NaHS溶液反应,则化学反应方程式为: 。
(3)在四种元素中A元素还可能与D元素有相似的化学性质,化学上称为对角线规则。请完成下列反应方程式:(已知:镁可以在氮气中燃烧得到氮化镁)
①Li单质也能在氮气中燃烧,其化学反应方程式为: 。
②铍单质与氢氧化钠溶液反应的离子方程式为: 。
13.有氧化铁和氧化铜的混合物a g,加入2mol/L的硫酸溶液50mL时,恰好完全溶解。若将这种混合物b g在氢气流中加热并充分反应,冷却后剩余固体的质量为 ( )
A.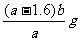 B.
B.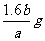 C.
C.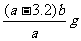 D.
D.
|
12.MOH和ROH两种碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中正确的是 ( )
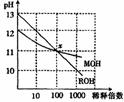
A.MOH是一种强碱
B.在x点,MOH完全电离
C.稀释前,c(ROH)=10c(MOH)
D.在x点,c(M+)=c(R+)
11.对于反应2A(g)+B(g)  2C(g),△H=-akJ/mol,(a>0)下列判断正确的是( )
2C(g),△H=-akJ/mol,(a>0)下列判断正确的是( )
A.2体积A和足量B反应,必定生成2体积C,放出a kJ热量
B.若反应容器的容积和温度不变,增大压强,平衡必定向右移动
C.平衡时,A消耗速度必定等于B生成速度的两倍
D.平衡时,A浓度必定等于B浓度的两倍
9.有关化学实验的基本操作中,正确的是 ( )
A.配制500mL某物质一定物质的量浓度的溶液,可用两个250mL的容量瓶
B.测定某溶液的pH,将干燥的试纸浸入到待测溶液,过一会儿取出,与标准比色卡比较
C.中和热测定实验中以环形铜丝搅拌棒代替环形玻璃搅拌棒会使测定值比理论值偏低
D.检验亚硫酸钠固体是否变质,先将少量样品溶于水中,再加入酸化的硝酸钡溶液
|
A.Cl2溶于水:Cl2+H2O
 2H++Cl-+ClO-
2H++Cl-+ClO-
B.氯化亚铁溶液中加入稀硝酸3Fe2++4H++NO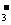 =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
C.苯酚钠溶液中通入少量的CO2,C6H5O-+CO2+H2O→C6H5OH+CO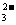
D.碳酸氢铵溶液与足量氢氧化钠溶液反应NH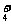 +OH-=NH3·H2O
+OH-=NH3·H2O
8.科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学性质的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上。最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如右图。下列说法肯定不正确的是 ( )

A.氢铝化合物可能成为未来的火箭燃料
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.Al2H6是离子化合物
D.Al2H6是非极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com