
13.下列关于反应能量的说法正确的是
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H = -216kJ·mol-1 ,反应物总能量>生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H = -571. 6 kJ·mol-1 ,H2的燃烧热为571.6 kJ·mol-1
D.H+ (aq) +OH-(aq) =H2O(l) ;△H= -57.3 kJ·mol-1 ,含 1molNaOH 的氢氧化钠
溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
12.元素A和元素B的原子序数都小于18,已知A原子的最外层电子数为a,次外层电子数为b,B原子的M层电子数为(a-b),L层电子数为(a+b),则下列叙述不正确的是
A.B元素位于周期表中的第三周期、第IVA族
B.A、B两元素原子通过共价键形成化合物BA2
C.A、B两元素所形成的化合物能与碳反应
D.A、B两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
11.如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
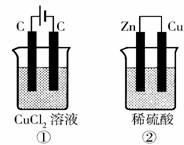
A.产生气体的体积:①>②
B.溶液的pH变化:①减小,②增大
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 2Cl--2e- Cl2 ↑ ②中负极 2H++2e- H2↑
10.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
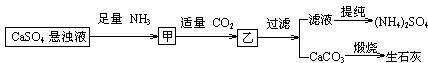
下列推断不合理的是
A.往甲中通适量CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
9.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如下图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是

A.铝片上生成的白毛是氧化铝和氧化汞的混合物
B.铝是一种较活泼的金属,
C.铝与氧气反应放出大量的热量
D.实验中发生的反应都是氧化还原反应
8.下列叙述正确的是
A.碘在碘化钾溶液中溶解度显著增大,原因是发生氧化还原反应生成I3-
B.氯化铁溶液遇KSCN溶液显红色,原因是生成Fe(SCN)3沉淀
C.氢氟酸需保存在塑料瓶中,原因是氢氟酸具有强酸性而腐蚀玻璃
D.氯化银难溶于水而溶于氨水,原因是生成Ag(NH3)2Cl溶液
7.要提纯下列物质(括号内物质为杂质),实验操作合理的是
A.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
B.苯(苯酚):加入足量的浓溴水,充分振荡,静置分层后分离
C.CO2(SO2):通入盛有Na2CO3溶液的洗气瓶
D.Mg(OH)2[Ca(OH)2]:放入水中调成浆状,加入足量MgCl2溶液,充分搅拌,过滤, 沉淀用蒸馏水洗涤
6.下列各组离子,在所给条件下能够大量共存的是
A.在AlCl3溶液中:Na+、CO32-、SO42-、NO3-
B.pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
C.加入(NH4)2Fe(SO4)2·6H2O晶体的溶液中:Na+ 、H+ 、Cl- 、NO3-
D.水电离出的[H+]=1×10-10 mol/L溶液中:K+、HCO3-、Cl-、S2-
5.向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必需提供下列哪项数据
A.M(OH)2溶液的物质的量浓度 B.与M CO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要再补充数据
4.已知锂和镁在元素周期表中有特殊“对角线”关系,它们的性质非常相似。下列有关锂及其化合物叙述正确的是
A.Li2SO4难溶于水 B.Li与N2反应产物是Li3N
C.LiOH易溶于水 D.LiOH与Li2CO3受热都很难分解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com