
23.(10分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍-镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
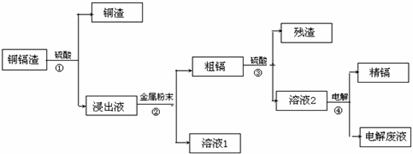
请回答下列问题:
(1)镉元素位于周期表中第 周期,第 族,其原子结构示意图为 ;
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
22.(8分)纯三氟化氮(NF3)在集成电路、大型屏幕液晶显示屏(TFT-LCD)的生产中,作为清洗剂之用。
三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)写出该反应的化学方程式。 。
(2)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(3)一旦NF3泄漏,可以用喷淋 溶液的方法减少污染。
(4)一种生产NF3的方法:氟气与液态氟化氢铵(NH4HF2)反应,产生NF3。
写出该反应的化学方程式:
21.(13分)过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:
2Na2CO3 + 3H2O2 = 2 Na2CO3·3H2O2 △H<0
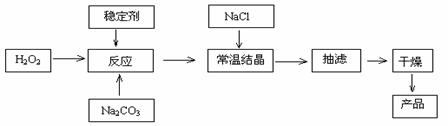
回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是 。
(2)下列物质可使过碳酸钠较快失效的是 。
A.MnO2 B.H2S C.稀硫酸 D.NaHCO3
(3)加入NaCl的作用是 。
(4)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是 。
(5)反应的最佳温度控制在15℃-20℃,温度偏高时造成产率低的可能原因有 ,
温度偏低时造成产率低的可能原因有 。
(6)以上生产流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是 。
20.(10分)小智同学有次实验时把SO2通入装有BaCl2溶液的试管中,出现了白色浑浊物。
(1)小智查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。
你认为他所查阅的数据为:SO2饱和溶液中各离子的浓度和 。
(2)小智对白色浑浊物的成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
|
|
假设 |
实验验证方法及现象 |
|
假设1 |
白色浑浊物是BaSO3。 |
。 |
|
假设2 |
白色浑浊物是BaSO4,造成原因是
。 |
把BaCl2溶液煮沸,冷却后滴加苯液封,再通入SO2。出现轻微浑浊。 |
|
假设3 |
白色浑浊物是BaSO4,造成原因是
。 |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中。 不出现浑浊。 |
请把上表填充完全。
(3)请你再提供一种假设。白色浑浊物是BaSO4,造成原因是 。
(4)写出在验证假设2的实验时,溶液中发生的反应的化学方程式。
。
19. Ⅰ(8分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
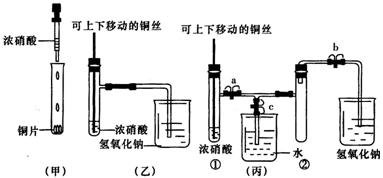
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是
(2)和甲装置相比,乙装置的优点是 ① ;② 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满试管②。
(4)当气体充满试管②后,将铜丝提起与溶液脱离,欲使烧杯中的水进人试管②应如何操作?
Ⅱ.(8分)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)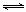 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
⑴下图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)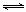 2NO(g)为
(填“吸热”或“放热”)反应。
2NO(g)为
(填“吸热”或“放热”)反应。
⑵2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K= 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2 的转化率为 。
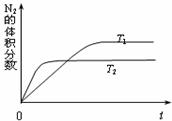
⑶为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
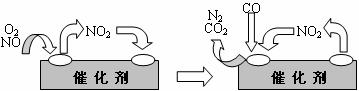
写出上述变化中的总化学反应方程式: 。
18.已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是
A.25℃时,0.1 mol·L-1HF溶液中pH=1 B.KSP(CaF2)随温度和浓度的变化而变化
C.该体系中KSP(CaF2)=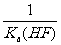 D.该体系中有CaF2沉淀产生
D.该体系中有CaF2沉淀产生
17.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的
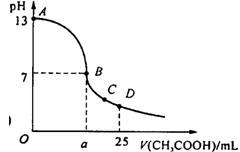
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
16.下列实验方案合理的是
A.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
B.测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放人锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定
C.用分液漏斗分离苯与硝基苯
D.除去氯化铁酸性溶液中的氯化亚铁:加入适量的过氧化氢水溶液
15.如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是
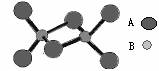
A.该化合物的化学式是Al2Cl6
B.该化合物是离子化合物,在熔融状态下能导电
C.该化合物在潮湿空气中不易变质
D.该化合物中不存在离子键,也不含有非极性共价键
14.下列反应的离子方程式正确的是
A.在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
B.电解饱和食盐水: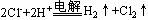
C.过量的铁与浓硝酸反应: Fe+6H++3NO3- = Fe3+ 十3NO2↑+3H2O
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com