
15.今有一混合物的水溶液,只能含有以下离子的若干种:K+、NH4+、C1-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaC12溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在,C1-可能存在 B.100mL溶液中含0.01molCO32-
C.K+可能存在,C1-一定存在 D.Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷(必做120分+选做32分,共152分)
|
14.铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法中,不正确的是 ( )
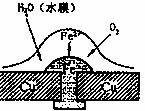
A.正极电极反应式为:2H++2e- H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
13.在密闭容器中,对已达到化学平衡的反应:2A(g)+B(g) 2C(g)△H<0,其他条件不变,则下列说法中正确的是 ( )
①升高温度时,c(B)/c(C)的比值变小
②降低温度时,体系内混合气体的平均式量变小
③加入B后,A的转化率增大
④加入催化剂,气体总的物质的量不变
⑤加入C后,则A、B的物质的量均增大
A.②③⑤ B.③④⑤ C.①②③⑤ D.全部
12.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案一:铜铝混合物 测定生成气体的体积

方案二:铜铝混合物 测定剩余固体的质量
下列有关判断中不正确的是 ( )
A.溶液A和溶液B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,测得铜的质量分数偏小
C.溶液A和溶液B选用稀硝酸
D.实验室中方案Ⅱ更便于实施
11.2007年3月,温家宝总理在十届人大五次会议上指出要大力抓好节能降耗、保护环境。“绿色化学”的最大特点在于它在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ( )
|
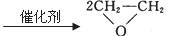
B.制备硫酸铜:2Cu+O2+2H2SO4 2CuSO4+2H2O
C.制备甲醇:2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
9.可提纯下列物质(括号内物质为杂质),实验操作最合理的是 ( )
A.碳酸钠溶液(碳酸氢钠):加入过量氢氧化钠溶液,蒸发结晶
B.氢氧化铁胶体(氯化铁):加入足量硝酸银溶液,过滤
C.乙酸乙酯(乙酸):加入适量乙醇和浓硫酸,热
D.氢氧化镁(氢氧化钙):放入水中搅拦成浆状后,加入足量氯化镁溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
|
A.同一主族的元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高
B.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB
C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M
D.升高温度可加快反应速率,其主要原因是反物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多
27.(10分)元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律


例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
(2)
|
|
Li |
Na |
K |
|
熔点 |
180 |
98 |
63 |
|
沸点 |
1347 |
881 |
756 |

根据以上三个图表回答:(M表示碱金属)
△H2(Li) △H2(Na), △H3(Li) △H3(Na),
已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
26.(10分)已知羰基化合物与饱和NaHSO3溶液可以发生以下反应:
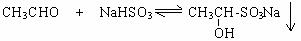
(1)羰基化合物和饱和NaHSO3的反应速率如下:
|
羰基化合物 |
CH3CHO |
CH3COCH3 |
C2H5COCH3 |
CH3CH2CH2COCH3 |
|
产率(1小时内) |
88.7 |
56.2 |
36.4 |
23.4 |
|
羰基化合物 |
(CH3)2CHCOCH3 |
(CH3)3CCOCH3 |
C2H5COC2H5 |
C6H5COCH3 |
|
产率(1小时内) |
12.3 |
5.6 |
2 |
1 |
可见,取代基对羰基化合物和NaHSO3反应的影响有(写出3条即可)
①
②
③
(2)利用以上可逆反应可以分离醛和酮的混合物,请写出能使醛与NaHSO3生成的沉淀重新溶解的试剂的化学式 (写出2种,属于不同类别的物质。)
(3)检验甲基酮(RCOCH3)通常用到下列2步反应来生成难溶于水的氯仿。

①写出第一步反应的化学方程式
②写出A的结构简式
(4)苯甲醛在浓碱作用下反应生成苯甲酸盐和苯甲醇,此反应的类型是 。
25.(10分)为测定某有机化合物A的结构,进行如下实验。
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下)。则该物质中各元素的原子个数比是 ;
(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是 ;
(3)根据价键理论,预测A的可能结构并写出结构简式 。
[结构式的确定]
(4)核磁共振氢原子光谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl-CH2-O-CH3)有两种氢原子(下图1)。经测定,有机物A的核磁共振氢谱示意图如图,则A的结构简式为 。

图1 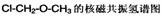 图2
图2 
[性质实验]
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: 。
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: 。
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式:
。
24.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com