
7.在单质的晶体中,一定不存在 ( )
A.化学键 B.分子间作用力 C.共价键 D.离子键
6.自然环境、能源与人们的生活息息相关,下列说法不正确的是 ( )
A.大量使用氟氯烃可能会破坏臭氧层
B.含植物营养元素氮、磷的生活污水有利于水生植物成长.可以净化天然水体
C.对二甲苯(Paraxylene,简称PX)是一种重要的有机化工原料。也是易燃易爆的危险品
D.乙醇是可再生的燃料,车用乙醇汽油值得提倡
33.(8分)[化学--有机化学基础]
有机物A、B、C、D、E、F有如下转化关系:
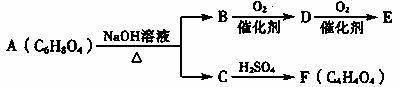
已知:①A可使溴水褪色,难溶于水
②F无支链
③E能发生银镜反应
请回答下列问题:
(1)E中所含有官能团的名称是 ;
(2)F的结构简式为 ,与F具有相同官能团的同分异构体的结构简式为 。
(3)由F制取A的化学方程式是 ;
(4)A不能发生的4反应有 (选填序号)。
①加成反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤酯化反应
32.(8分)[化学--物质结构与性质]
已知A、B、C、D四种元素的原子序数依次增大。A与C原子的价电子构型相同,A的第一电离能是同族中最大的;B原子核外有三个未成对电子,C原子的价电子构型为3s,D原子的3p轨道上有两对成对电子。
(1)A、B形成的10电子分子中,分子空间构型为 。该分子常常作为配位体形成络合物,请写出其与Zn(OH)2反应形成的络合物的化学式 。
(2)B原子和氧原子相比 的第一电离能更大。
(3)A分别与B、D形成的常见化合物在水中的溶解度都很大,其中 (写化学式)的溶解度更大,原因是
。
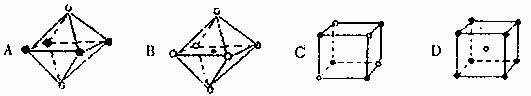
(4)下列图象是从某些晶体结构图中分割出来的部分结构图,试判断其中符合元素C、D形成的晶体结构的图象是 。
31.(8分)[化学--化学与技术]
(1)冶金废水含有[Au(CN)2],其电离的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaC1O将CN-氧化为CO32-和一种元毒气体,该反应的离子方程式为 ,在酸性条件下,C1O-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是
。
(2)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡化率和产生等有关信息:
表一:原料、反应条件、平衡转化率、日产量
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100-125℃ |
PdC12-CuC12、100-125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源于生产工艺
|
|
原料生成工艺过程 |
|
乙炔 |
 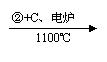 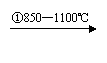 CaCO3 CaO CaC2 C2H2 |
|
乙烯 |
来源于石油裂解 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
30.(16分)工业和交通运输业的迅速发展,机动车数量日益增多,人类向大气中大量排放烟尘和SO2等有害气体等,对大气造成了严重的污染。一研究性学习小组对某市空气污染情况和SO2参与的反应,进行了研究。
(1)空气污染易形成酸雨。从环境保护的角度认为:雨水的pH<5.6时,就判断为酸雨。该小组同学测定某次雨水中只含硫酸,且浓度为5×10-5mol·L-1,这次降雨 (填是或不是)酸雨。
(2)该小组同学欲测定空气(含氮气、氧气、二氧化碳、二氧化硫等)中SO2的何等积百分含量(标准状况),请利用溴水、BaC12溶液及必要的实验仪器设计实验方案,写出简要的实验步骤
。
上述实验过程中发生反应的离子方程式为 ,其中SO2参与反应中,SO2显 性。
(3)在T℃时,反应2SO2(g)+O2(g) 2SO3(g) △H<0的平衡常数K=6×102,
则
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”“减小”或“不变”)。
②在T℃时,某学生向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态 (填“是”或“否”),化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),你判断的依据是
。
[选做部分]
|
共8个题,考生从中选择2个物理题、1个化学题和狐假虎威生物题作答。
29.(14分)金属铝广泛应用于现化生产和日常生活中。
已知:4A1(s)+3O2(g)=2A12O3(s) △H=-3351.4kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1633.2kJ·mol-1
C8H18(1)+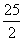 O2(g)=8CO2(g)+9H2O(1) △H=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(1) △H=-5518kJ·mol-1
将铝用作燃料已成为现实。回答下列问题:
(1)写出工业制铝的阳极电极反应式 。
(2)①铝用作燃料相对于含碳燃料有明显优点,请你写出其中一条
;
②铝用作燃料相对于氢气也有明显优点,但也有不足,既燃点高。若要在常温常压不使用催化剂的情况下点燃铝,除了应防止表面生成致密的氧化膜外,还应采取的措施是 。
(3)铝热反应在生产中应非常广泛。请写出Fe2O3(s)和A1(s)反应的热化学方程式 。
(4)铝热实验中能看到有熔融物生成,为探究该熔融物的成分,某学生查阅资料如下:
|
物质 |
A1 |
A12O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
|
经分析,该同学推测,铝热反应所得到的熔融物应是铁铝合金。请设计一下简单的实验方案,证明上述所得的块状熔融物中含有金属铝(简述实验操作、现象及结论)
。
28.(12分)下图甲是某课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置;
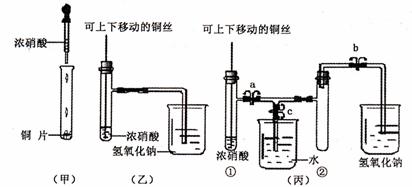
(1)甲、乙、丙三个装置中共同发生的离子反应方程式是 。
(2)和甲装置相比,乙装置的优点是
。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。应关闭弹簧夹 ,打开弹簧夹 ,才能使NO2气体充满试管②。
(4)当气体充满试管②后,将铜丝提起与溶液脱离,欲使烧杯中的水进入试管②应如何操作 。
(5)当试管②中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。(不考虑NO2与N2O4的转化且该实验条件下气体摩尔体积设为VmL/mol)
2. 第Ⅱ卷所有题目的答案考生须用黑色签字笔、钢笔或圆珠笔在答题纸上,在试题卷上答题无效。
[必做部分]
1. 第Ⅱ卷共16个题。其中23-30题为必做部分,31-38题为选做部分,考生必须从中选择2个物理、1个化学和1个生物题作答。不按规定选做者,阅卷时将根据所选科目题号的先后顺序只判前面的2个物理题、1个化学题和1个生物题,其他作答的题目答案无效。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com