
29.(本题包括两部分,共19分)
(Ⅰ)(12分)某有机物的球棍型如下图所示:
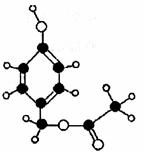
(1)请写出该物质的分子式 ,
(2)该物质在一定条件下,可以发生水解反应,生成只含碳、氢、氧三种元素的A、B两种物质(它们的相对分子质量关系是A>B)
①请写出该物质发生水解反应的化学方程式:
|

|

|
|

 ③B可以用以下方法制得:
X
Y Z
W
B
③B可以用以下方法制得:
X
Y Z
W
B
其中W能发生银镜反应。
则I属于 反应;IV属于 反应(填反应类型);
写出W发生银镜反应的化学方程式:
(3)该物质有多种同分异构体,请写出两种符合以下三个要求的同分异构体的结构简式
a 、含苯环;b、只有两个互为间位的取代基;c 、能发生银镜反应。
、 。
(Ⅱ)(7分)
为确定某液态有机物X(分子式为 C2H6O2)的结构,某同学准备按下列程序进行探究。请完成下列填空。己知:①一个碳上连两个羟基的物质 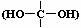 很不稳定;
很不稳定;
②分子中不存在过氧键 (-O-O一 ) 。
(1)预测 X 的稳定结构可能有 种
(2)设计实验方案证明 X 的结构 ( 表格可不填满 )
|
实验原理 |
预期生成H2的体积(标准状况) |
对应X的结构简式 |
|
取6.2gX与足量钠反应,通过生成氢气的体积来确定X分子中能与金属钠反应的氢原子数目,进而确定X的结构 |
|
|
|
|
|
|
|
|
|
|
|
|
|
(3)根据实验方案,从下列仪器中选择所需仪器,画出实验装置图:

要求:①本题装置示意图中的仪器可以用上面的方式表示
②若用具体装置图表示,铁架台、石棉网、酒精灯、连接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,用“△” 表示。
28. (15分)铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
(15分)铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
[探究一]实验方案:铝镁合金 测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”或“偏低”)
[探究二]
 实验方案:铝镁合金
测定生成气体的体积
实验方案:铝镁合金
测定生成气体的体积
实验装置如图,
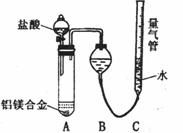
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
① ②
[探究三]
实验方案:称量x g铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。
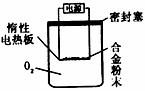
问题讨论:
(1)欲计算Mg的质量分数,
该实验中还需测定的数据是
(2)若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
[实验拓展] 参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。(书写形式可以模仿探究一、二)
27.(12分)下列图1中B是一种常见的无色无味的液体。C是一种有磁性
的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
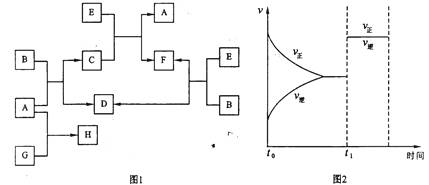
(1)写出A+B→C+D的化学方程式 ;
(2)原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。E和N2是等电子体,请写出E的电子式 ;
(3)在101kPa和150℃时,可逆反应E(g)+ B(g) F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
;
F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
;
A.升高温度 B.增大压强 C.加入催化剂
(4)若G是一种黄色固体单质,16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式 ;少量H的浓溶液滴入沸水中,继续煮沸,生成了一种红褐色的液体,请用离子方程式表示该过程 。
26.(14分)U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:
① WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;
② Z的单质在X2中燃烧的产物可使品红溶液褪色;
③ V的单质在X2中燃烧可生成VX和VX2两种气体;
④ Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)WU3分子的空间构型为 Z元素在周期表中的位置是 。
(2)写出Y2X2与水反应的化学方程式: 。
(3)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(4)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为
。
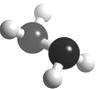
(5)已知下图的球棍模型所表示的是由U、W两种元素组成的共价化合物A,
则A的分子式为 A与氧气及氢氧化钾溶液还可构成燃料电池。
正极的电极反应为:
13.下列叙述中不正确的是 ( )
A.氯碱工业中阳离子交换膜的作用是阻止阳离子通过
B.假酒中严重超标的有毒成分主要是甲醇
C.光导纤维是以二氧化硅为主要原料制成
D.酸雨形成的主要原因之一是工业大量燃烧含硫燃料
第Ⅱ卷(本卷共10题,共174分)
|
12.青藏铁路于2006年7月1日全线通车,为防止旅客出现高原反应,列车上特备有氧气罐,青藏高原上水烧开的温度低于1000C。如右图所示,夹子开始处于关闭状态,试管①内盛有960C的水,①内的空气处于标准大气压。将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A与气体B的组合不可能是下列中的 ( )
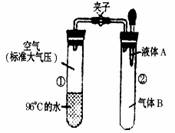
A.氢氧化钠溶液、二氧化碳 B.硝酸钾溶液、氯化氢
C.水、氧气 D.水、二氧化氮
11.下列说法正确的是 ( )
A.常温下,在pH<7的酸性溶液中,不可能存在NH3·H2O
B.常温下.在pH=7的NH4Cl和NH3·H2O的混合液中。c(NH4+)=(Cl-)
C.将等物质的量的NH4Cl和NH3·H2O溶于水配成溶液.则溶液中c(NH4+)<(Cl-)
D.在0.1moL/L的K2S溶液中:c(K+)=c(S2-)+c(HS-)+c(H2S)
9.某可逆反应A(g)
 2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA
,甲容器中3min后B的浓度达到0.12mol/L保持不变,乙容器中2min后C的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )
2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA
,甲容器中3min后B的浓度达到0.12mol/L保持不变,乙容器中2min后C的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )
A.甲容器中温度比乙容器高 B.乙容器中温度比甲容器高
C.乙容器中使用了催化剂 D.甲容器中使用了催化剂
|
① 酸性氧化物均能与碱发生反应,
② 弱酸与盐溶液反应可以生成强酸,
③ 发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成,
④ 两种酸溶液充分反应后,所得溶液呈中性,
⑤ 有单质参加反应,但该反应不是氧化还原反应,
⑥ 两种氧化物发生反应有气体生成
A.①②③④⑤⑥ B.①③⑤⑥
C.①②③⑤ D.③⑤
8.将下列离子混合在同一溶液中,必然会产生沉淀的一组是 ( )
A.Na+、Al3+、Cl-、OH- B.Ag+、NH4+、NO3-、OH-
C.H3O+、Ca2+、CO32-、NO3- D.Na+、Fe3+、Cl-、CO32-
7.2008年北京奥运会的主体育场的外形好似“鸟巢”(The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸。下图是三种巢式硼烷,有关说法正确的是 ( )
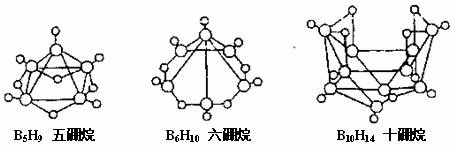
A.硼烷与水的反应是非氧化还原反应
B.这类巢式硼烷的通式是BnH n+4 (n为合理值)
C.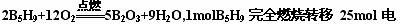
D.B5H9中H原子的成键方式都相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com