
21.(6分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
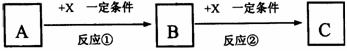
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) 。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,X的化学式可能为(写出不同类物质) 或
20.(10分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是_____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水
c.苯酚 d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱
所需气体发生装置是_____________(选填代号)。

(6)操作Ⅰ的名称是_________;操作Ⅱ是根据KMnO4和K2CO3两物质在_________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
18.下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是 ( )
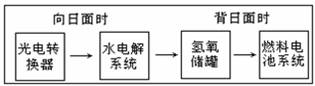
A.该能量转化系统中的水也是可能循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH- 2H2O+O2+4e-↑
2H2O+O2+4e-↑
D.燃料电池放电时的负极反应:H2+2OH- 2H2O+2e-
2H2O+2e-
|
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

试回答下列问题:
(1)试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为不合理,请提出你的猜想 ,并设计一个简单的实验加以验证(若你认为合理,该空不要作答)
。
17.将Na2O2逐渐加入到含有A13+、Fe2+的混合液中,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mo1)的关系如图所示,则原溶液中A13+、Fe2+的物质的量分别为( )

A.4mol、2mol B.2mol、4mol D.1mol、2mol D.2mol、1mol
16.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳环中。比较常见的石墨间隙化合物是化学式为KCx的青铜色化合物,其平面图形如图。则x值为 ( )

A.8 B.12 C.24 D.60
15.以下说法正确的是 ( )
A.原子间必须通过电子得失或形成共用电子对而形成化学键,而与原子核无关。
B.非金属元素的原子间只形成共价键,金属元素的原子与非金属元素的原子间只形成离子键。
C.原子晶体的原子间只存在共价键,而形成分子晶体的原子间均存在分子间作用力。
D.原子是化学变化中的最小微粒,意即化学变化不产生新元素,核反应产生了新元素不为化学变化。
14.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是 ( )
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水。
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+。
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-。
D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+。
13.现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是 ( )
A.若混合前三溶液pH相等,将它们同等倍数稀释后,NaOH溶液pH最大
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
12.如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊,若打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊.据此判断气体和广口瓶中盛放的物质是 ( )

A.H2S和浓H2SO4 B.SO2和NaHCO3溶液
C.Cl2和NaHCO3溶液 D.Cl2和氯水
11. 对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中不正确的是 ( )
pC(g)+qD(g);△H<0。下列结论中不正确的是 ( )
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.56倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com