
2.Se是人体必需的微量元素。下列关于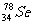 和
和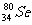 的说法,正确的是 ( )
的说法,正确的是 ( )
A.二者互为同素异形体 B.二者属于同一种元素
C.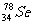 和
和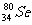 的性质相同 D.
的性质相同 D.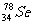 和
和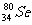 分别含有44和46个质子
分别含有44和46个质子
1、环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是 ( )
A、温室效应--二氧化碳 B、光化学污染--二氧化氮
C、酸雨--二氧化碳 D、臭氧层破坏--氟氯烃
31、2gCu2S和CuS的混合物在酸性溶液中用400mL 0.075 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+ → 10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+ → 5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)写出KMnO4与(NH4)2Fe(SO4)2溶液反应的离子方程式:
____________________________________________________________________
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中 Cu2S的质量分数为 。
30、氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3 → 2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
⑵准确称取0.2500 g CuCl样品,放到足量的0.5 mol/L FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol/L的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反化学反应为
Fe3++CuCl → Fe2++Cu2++Cl- Ce4++Fe2+ → Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
29、复方阿司匹林主要含有阿司匹林、非那西汀和咖啡因三种成分。已知:
①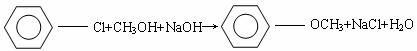
②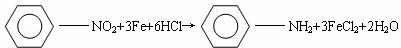
③ 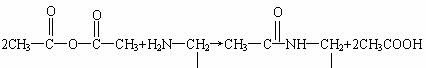
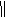 (醋酸酐)
H2N-CH2 CH3-C-NH-CH2
(醋酸酐)
H2N-CH2 CH3-C-NH-CH2
O
(1)利用如下反应可合成非那西汀(一些反应未注明)
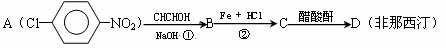
写出反应类型:①__________________;②____________________;
D的结构简式是_______________________________。
(2)阿司匹林是一种酯,经酸性水解可生成水杨酸和乙酸。若用甲醇和水杨酸发生酯化反应可生成水杨酸甲酯,即另一种镇痛药--冬青油,它的结构简式为: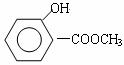 。则水杨酸的结构简式为________________________;阿司匹林的结构简式为_______________________________。
。则水杨酸的结构简式为________________________;阿司匹林的结构简式为_______________________________。
(3)阿司匹林有多种同分异构体,请写出其中一种的结构简式,该物质不与金属钠反应,且苯环上的一氯代物只有两种:__________________________。
28、已知在一定条件下乙炔与醛(或酮)可发生加成反应,生成醇炔。如:
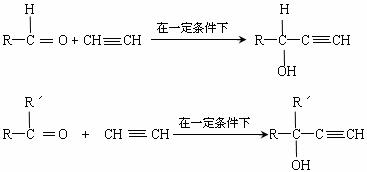
下面是一种工业上以乙炔为原料合成顺丁橡胶的示意图:
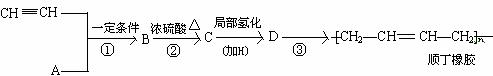
根据以上事实回答如下问题。
(1)写出A → D的结构简式。
A_______________,B_______________,C________________,D_________________。
(2)写出①②③反应的化学方程式并注明反应的类型。
① ________________________________________________________( );
②________________________________________________________( );③________________________________________________________( )。
(3)要求制取合成橡胶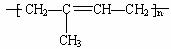 ,除乙炔外,可代换A的化合物的结构
,除乙炔外,可代换A的化合物的结构
简式是 __________________。
27.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
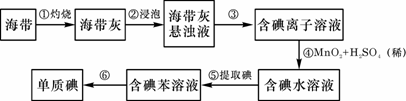
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
26、工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
SO2+I2+2H2O→H2SO4+2HI

(1)混合气体进入反应管后,量气管内增加的水的体积等于 _____ 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 ____________________代替(填写物质名称)。
(4)若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
25、下表是元素周期表的一部分
|
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
二 |
|
① |
|
② |
③ |
④ |
|
|
三 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
四 |
|
|
|
|
|
|
⑩ |
(1)表中③元素的氢化物的电子式为_______________,此氢化物的水溶液的pH比⑨元素的氢化物的水溶液的pH_________(填“大” 、“小” 或“相等”),上述两种氢化物形成的化合物其水溶液呈__________性(填“酸” 、“碱” 或“中”)
(2) ⑤⑥⑧⑨元素形成的简单离子中离子半径最大的是_____________(填离子符号)
(3) ①元素与⑥元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式______________________________________
(4) ⑦元素与④元素形成的化合物属____________晶体。
(5)在⑨与⑩的单质中,化学性质较活泼的是__________,写出可以验证该结论的一个化学反应方程式__________________________________________。
24、有可逆反应A(g) + 3B(g) 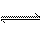 2C(g) + Q (Q > 0)
2C(g) + Q (Q > 0)
(1)写出该反应的平衡常数表达式:________;升高温度,平衡常数K将_________(填“增大”,“减小”,“不变” )。
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示:
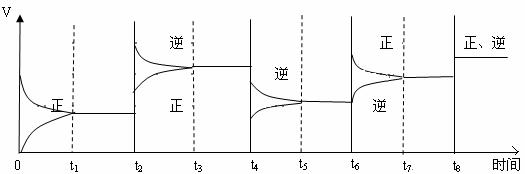
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,试判断改变的是什么条件。
t2时____________;t4时___________;t6时__________;t8时___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com