
22、(11分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是固体金属单质,Y中阳离子与阴离子个数比为2:1 ,化合物X、Y、A、D、E、G的焰色反应为黄色,I是白色沉淀。
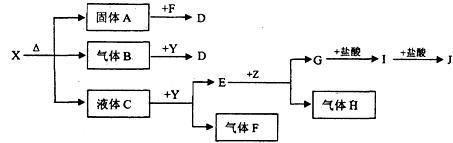
(1)写出X、E、I的化学式。X E I 。
(2)写出Y的电子式 。
(3)关于Y的说法正确的是 。
A.Y是氧化物 B.Y是过氧化物
C.Y是含有非极性键的离子化合物 D.Y是碱性氧化物
(4)写出B和Y反应的化学方程式: 。
(5)X和G的溶液能反应吗?如能反应,写出反应的离子方程式;如不能反应,请说明理由:
21.(10分)用如图所示装置进行下列实验。
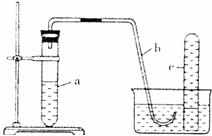
(1)在检查装置气密性后,向试管a中加入10mL6mol·L-1稀硝酸和lg铜片,立即将带有导管的橡皮塞塞紧管口。请写出试管a中有可能发生的所有反应的化学方程式
。
(2)该实验刚开始速率缓慢,随后逐渐加快,这是由于
。
(3)为了使产生的气体不至于逸散到空气中,请写出向试管a中加入试剂的操作方法
。
(4)欲较快地制取NO,可采取的措施有(列举两种) 、
。
20.(9分)饱和氯水与石灰石的反应是制取较浓的HClO溶液方法之一。某同学运用这一方法,尝试制取HC1O溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验;
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生;
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份: 。
第二份: 。
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式) 。
19.在烧杯中加入铁和铜的混合物,然后加入一定量的稀硝酸,充分反应后,剩余金属的质量为m1g;再向该烧杯中加入一定量的醋酸,充分振荡后剩余的金属质量为m2g。则m1与m2之间的关系一定正确的是 ( )
A.m1可能等于m2 B.m1一定等于m2
C.m1可能大于m2 D.m1一定大于m2
第Ⅱ卷(非选择题 共42分)
18.某学生用NaHCO3,和KHCO3,组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
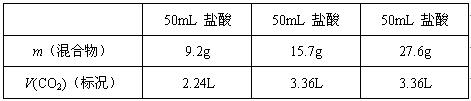
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0mol·L
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
17.有10 g不纯CaCO3样品与足量盐酸作用后生成4.44 g CO2,且溶液中残留难溶物质。则对于此样品中是否存在①MgCO3 ②K2CO3 ③SiO2杂质的判断正确的是( )
A.肯定含①③,不含② B.肯定含①③,可能含②
C.肯定含②③,不含① D.肯定含②③,可能含①
16.t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1。向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是( )
A.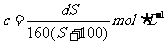 B.
B.
C. D.
D.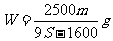
15.已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下 ( )
|
加入试剂 |
稀硫酸 |
浓硫酸、加热 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
红色固体 和蓝色溶液 |
无色气体 |
无色气体 和蓝色溶液 |
红棕色气体 和绿色溶液 |
由此推出本次氢气还原氧化铜实验的产物是
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
14.实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为lmol·L-1。下面四个选项中能达到此目的的是
A.NH4+、Na+、NO3-、Cl- B.Cu2+、K+、SO42-、NO3-
C.H+、K+、HCO3-、Cl- D.、K+ Na+、Cl-、SO42-
13、蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com