
28.(10分)
(1)实验室常用浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平):KClO3+HCl→KCl+Cl2↑+H2O
①配平上述反应化学方程式:
KClO3+ HCl= KCl+ Cl2↑+ H2O
②当产生6.72L(标况)Cl2时,则反应中转移电子的物质的量为 mol,这时溶液的Ph=a,比反应前升高了一个单位,则原盐酸的物质的量浓度为(忽略溶液的体积变化) 。
(2)某些化学反应可用下式表示:A+B→C+D,若A、B、C、D四种物质中有三种均含有同一种元素,且该元素在这三种物质中的化合价均不同,请写出符合上述条件的两个反应的化学方程式(在这两个反应中,变价元素不能位于周期表同一主族):
; 。
(3)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)

3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) 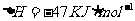
Fe3O4(s)+CO(g)+3FeO(s)+CO2(g) 
请写出CO还原FeO的热化学方程式: 。
3.第Ⅱ卷所有题目的答案考生须用0.5mm黑色签字笔答在答题纸规定位置上在试题卷上答题无效。
[必做部分]
15.通过对实验的观察、分析推理、得出正确的结论是化学学习的主要方法之一。对下列实验事实的解释正确的是 ( )
第Ⅱ卷(必做120分+选做32分,共152分)
14.已知pH=2的盐酸与PH=12的氨水等体积混合,下列关于溶液中离子浓度的关系正确的是 ( )
A.c(NH+4)=c(Cl+),c(H+)=c(OH-)
B.c(Cl-)>c(NH+4)>c(H+)>c(OH-)
C.c(Cl-)>c(NH+4)>c(OH-)>c(H+)
D.c(NH+4)>c(Cl-)>c(OH-)>c(H+)
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
淀粉能与Cl2发生显色反应 |
|
B |
浓硝酸在光照条件下变黄 |
浓硝酸不稳定,生成有色产物能溶于浓硝酸 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO2-4 |
|
D |
铜片放入浓硫酸中,无明显变化 |
说明铜在冷的浓硫酸中发生钝化 |
13.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是 ( )
A.D元素处于元素周期表中第3周期第VIA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物,具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
12.25C0时,相同物质的量浓度的下列溶液:①NaCl ②NaOH③ H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小的顺序排列的一组是 ( )
A.④>③>②>① B.②>③>①>④ C.④>①>②>③ D.③>②>①>④
11.下列离子方程式书写正确的是 ( )
A.氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++Cl2=2Fe3++3Cl-
C.钠与水反应:Na+2H2O=2OH-+H2↑
D.向硅酸中加入氢氧化钠溶液:H++OH-=H2O
10.随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP
[化学式为Cam(PO4)n(OH)2],已被医疗上用于修补人的骨骼和牙组织,HAP的化学式中m等于 ( )
A.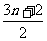 B.
B. C.
C. D.n+1
D.n+1
9.科学研究需要以科学的研究方法为依托。某同学在学习了金属钠能跟水的反应后,要研究金属钠跟乙醇的反应,并分析以上两个反应的异同点。在以上探究过程中没有用到的科研方法是 ( )
A.实验法 B.观察法 C.分类法 D.比较法
23.(12分)将总物质的量为4mol的Na2O2和Al2(SO4)3的混合物投入足量水中,充分反应后生成y mol沉淀(y>0)。
(1)试分步写出所有可能发生反应的化学方程式
。
(2)若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值和y=f(x)关系式填写在表内(可不填满,也可补充)。
|
序号 |
x值 |
y=f(x) |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com